Mouche de l'olive
Bactrocera oleae

- Dacus oleae
La mouche de l’olive (Bactrocera oleae) est une espèce d'insectes diptères brachycères de la famille des Tephritidae et de la sous-famille des Dacinae.
C'est un ravageur de l'olive, responsable de dégâts substantiels dans le bassin méditerranéen et dans les zones du monde à climat méditerranéen où cette culture a été introduite. Cette mouche ne parasite que les oliviers.
Biologie et description
C'est un moucheron mesurant 4 à 5 mm de longueur.
Accouplement et ponte
Les femelles nouvellement écloses émettent des phéromones qui attirent les mâles. Dès la fécondation, la femelle se met à la recherche d'olives. Elle incise la peau d'une olive de taille convenable avec son ovipositeur, introduit l'œuf sous la peau. Avec l'extrémité de sa trompe, elle aspire le jus de l'olive, badigeonne en léchant autour de la surface de la piqûre et réabsorbe les liquides.
La femelle marque l'olive avec le dépôt d'une substance odorante. Ce marquage a pour but d'empêcher la mouche de piquer la même olive deux fois mais n'empêche pas d'autres mouches de piquer.

De l’œuf à la pupe
À une température moyenne de 25 °C, l'œuf éclot au bout de deux à trois jours en donnant une larve. Cette larve est blanche dans les olives jeunes (vertes) et acquiert une teinte vineuse dans les olives mûres (noires). Elle creuse une galerie dans la pulpe de l'olive en restant à l'intérieur. L'olive attaquée vire au noir et peut tomber au sol.
Au bout de 21 jours, la larve vient forer l'épiderme de l'olive avec un trou d'un millimètre de diamètre puis recule dans le fruit et se transforme en une pupe. Au bout de dix jours, c'est une mouche adulte qui s'extirpe de la coque de la pupe, sort de l'olive, se sèche et s'envole. Le cycle aura duré un mois depuis la ponte[1].
En automne, quand les températures commencent à baisser, les olives piquées tombent. Les asticots s'enterrent à 10, 15 cm dans le sol où ils se transforment en pupes. Ils passent l'hiver jusqu'à ce que la montée de température provoque le réveil et la sortie des mouches du sol, quand celui-ci atteint 25 °C (mi-juin).
L'adulte
À l'état adulte, les mouches mesurent 4 à 5 mm de long. L'abdomen est de couleur orangé avec deux striures noires. Les ailes sont transparentes, sauf une tache noire à chaque extrémité. Le dessus du thorax porte une tache argentée entre les deux implantations d'ailes.
La femelle se distingue du mâle par son abdomen muni d'un ovipositeur. Elle perce la peau des olives pour déposer son œuf lorsque l'olive mesure 7 mm à 9 mm. Le trou est peu visible à l'œil nu mais la mouche dépose une marque odorante sur l'olive où elle ne pond qu'un œuf. Elle peut ainsi piquer jusqu'à 400 olives. Plusieurs femelles peuvent piquer la même olive en cas de pullulation de l'insecte.
Un adulte peut vivre jusqu'à six mois, se nourrissant de jus sucrés, de nectars, de rosée, de miellats de cochenilles ou de jus de décomposition de fruits et de fumiers (déjections d'oiseaux ou autres animaux). L'adulte est inhibé par les températures trop basses (moins de 25 °C). Sous toutes ses formes (œuf, larve, asticot ou imago) la mouche est tuée à 0 °C ou par les fortes chaleurs (supérieures à 42 °C). L'adulte a besoin d'ombre pour s'abriter. Jusqu'à cinq générations peuvent se succéder entre juin et octobre voire novembre (une génération = un « vol »).
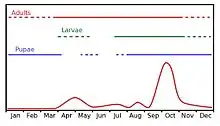
Durée de vie moyenne
La durée de vie d’une mouche de l’olive adulte est de 1 à 2 mois, mais elle peut survivre plus longtemps en se plaçant en vie ralentie.
Besoins alimentaires
Au sortir de la pupe, la mouche adulte dispose des réserves accumulées par la larve qui a rongé la chair de l’olive. Néanmoins, elles recherchent des aliments liquides :
- les substances sucrées comme les nectars, les miellats (qui lui apportent des calories),
- les substances azotées qu’elles trouvent dans les matières en décomposition comme les fumiers frais, les déjections d’oiseaux, etc.
Il faut noter que les bactéries vivant naturellement à la surface de l’olive attirent les mouches qui dégorgent (voir ci-dessus) de la salive sur la peau de l’olive, après avoir piqué avec leur ovipositeur et absorbent ensuite salive, sève du fruit blessé et bactéries. Les bactéries qui ont pénétré avec l’ovipositeur sont également utiles au développement de la future larve dans l’olive. Les bactéries de la mouche de l'olive sont des symbiotes dont, à tout moment de son cycle (larve, pupe et imago), l'insecte a besoin pour vivre.
On peut comparer avec les mouches domestiques :
« Les mouches liquéfient les aliments en régurgitant sur eux des sucs digestifs et le contenu de leur estomac. Ce « liquide » est ensuite aspiré par les pièces buccales capables de sucer ; ce faisant, ces insectes ramassent des organismes pathogènes, qui peuvent s'accumuler sur leur corps pour être transférés par contact avec d'autres surfaces, ou survivre au passage à travers leur appareil digestif pour être déposés avec les excréments de mouche[2]. »
La lutte contre le ravageur
Sensibilité des fruits
Les variétés (cultivars) d'olives les plus sensibles sont la Lucques (olive précoce, Hérault)[3], la Bouteillan[4], la Verdale de l'Hérault[5]...
Il est à noter que ce sont des cultivars à gros fruits, à peau fine.
Stratégies
On distingue cinq sortes de lutte : physique, chimique, non chimique (piégeage), biologique et transgénique.
Lutte physique
C'est une lutte préventive qui consiste à empêcher le parasite de se développer et d'attaquer les olives : il existe plusieurs techniques, notamment la pulvérisation d'argile sur les olives qui empêche la mouche de pondre sur les olives. Cette technique consiste à pulvériser sur les olives une émulsion de poudres (kaolin ou argile blanche, ilménite ou argile verte, talc). L’application doit être renouvelée après chaque pluie.
Des pièges peuvent servir à évaluer la pression du ravageur.
Lutte chimique
C'est une lutte curative qui consiste à tuer les vers dans l'olive, dès leur éclosion et ceux qui ont commencé à se développer.
Résistance aux pesticides
La pupe est très résistante aux produits insecticides et aux conditions climatiques. En ce qui concerne les adultes, pour éviter des phénomènes de résistance au produit, les applications de spinosad avec appât sont limitées pour chaque année à quatre applications maximum, sur deux générations de mouche[6]. Il est difficile de trouver des études sur la résistance de la mouche de l'olive aux pesticides.
Une étude récente menée au Japon[7] a mis en évidence la faculté de certains insectes de résister aux insecticides grâce à l'action de leurs bactéries symbiotiques. Les bactéries Burkholderia sp. décomposent les molécules d'un insecticide organophosphoré, le fénitrothion. Le genre Burkholderia est ubiquiste qui pourrait bien être un symbiote de Bactrocera. La contamination de l'hôte insecte se fait lors de la vie nymphale dans le sol, ce qui est le cas de la mouche de l'olive.
Lutte non chimique
C'est le piégeage massif. La lutte non-chimique se fait par des pièges de fabrication maison dits pièges Olipe constitués par des bouteilles d'eau minérale récupérées percées de petits trous de 4 mm sur le flanc supérieur de la bouteille (piège Olipe espagnol). La bouteille est remplie à moitié d'une solution de phosphate de diammonium à 40 g/L bien clarifiée ; il peut y être ajouté une grosse cuillerée de mélasse ou de miel et une cuillerée de vinaigre. L'ajout de colorant alimentaire jaune ou la présence d'une bande jaune autour de la bouteille permet d'attirer les mouches (effet chromatique attractif). La bouteille est suspendue dans l'arbre, vers le sud-ouest (vers le coucher du soleil), à l’ombre d’une branche. En cas de fortes chaleurs, les mouches peuvent venir du côté nord de l'arbre (côté abrité du soleil). Une autre solution attractive consiste à utiliser des déchets de poisson putréfiés (sardines), une solution d'hydrolysat de protéines ou une solution de levure de bière.
En Languedoc, lors des canicules des étés 2005 et 2006, la chaleur extrême a inhibé l'activité des mouches de l'olive. La période critique pour les olives en cours de maturation se situe fin août-début septembre, après les premiers orages qui rafraîchissent et humidifient l'atmosphère. L'activité piqueuse atteint un sommet fin septembre et l'infestation maximale est atteinte début octobre. Pendant l'été 2014, l'abondance des pluies a tempéré la chaleur, gonflé les olives et favorisé la prolifération des mouches ainsi que l'activité de champignon microscopiques (Camarosporium dalmaticum et Gleosporium olivarum ou Gloeosporium olivarum J.V. Almeida, (1899)[8]), dans toute la région méditerranéenne française.
 Jeune olive fraichement parasitée.
Jeune olive fraichement parasitée. Larve au stade III.
Larve au stade III. Pupe.
Pupe. Trou montrant la sortie d'un adulte.
Trou montrant la sortie d'un adulte. Piège Olipe amélioré.
Piège Olipe amélioré.
Action des composés du cuivre
Il y a à la surface de nombreux fruits une pellicule cireuse, blanchâtre, la pruine. « Cette fine pellicule est en fait une cire que l'on retrouve sur un très grand nombre de végétaux », selon Interfel (Interprofession des fruits et légumes frais). La pruine retient, en effet, des micro-organismes[9], dont les bactéries dont la mouche à besoin. Le cuivre (ainsi que ses composés) est reconnu comme agent bactéricide[10]. La pulvérisation de bouillie bordelaise, fin juin, au moment de la ponte des mouches perturbe sa nutrition et le développement de sa larve. C’est un des facteurs qui freinent son développement. La manière de se nourrir des mouches leur fait absorber la bouillie bordelaise présente sur l'olive. Ce puissant bactéricide va détruire aussi les endosymbiotes de leur intestin moyen. La mort de leur endosymbiotes pourrait entraîner celle de la mouche de l'olive, ou tout au moins la stérilité de la femelle[11].
Plantes hôtes
Cinq plantes hôtes d'insectes parasites eux-mêmes attaqués par des parasitoïdes ont été étudiées[12] :
- laitues (Lactuca viminea et Lactuca serriola)[13],
- asphodèles[14],
- molène[15],
- Inula viscosa[16],
- Foeniculum vulgare[17].
Ces plantes sont recommandées dans le cadre de la lutte biologique et ont vocation à être protégées dans les oliveraies comme hébergeant des auxiliaires de l'oléiculteur.
Insectes parasitoïdes
Des hyménoptères parasitoïdes tels que Pnigalio mediterraneus, comme aussi Eupelmus urozonus, Psyttalia (=Opius) concolor, Eurytoma martelli, Cyrtoptix latipes, ont été reconnus comme les parasitoïdes majeurs de la mouche de l'olive. La lutte biologique se fait par l'entretien d'un environnement végétal adéquat autour des cultures (rééquilibrage écologique d'une monoculture, voir ci-dessus). Les oliveraies seront entourées de haies végétales[18].
Pnigalio mediterraneus est cité comme parasitoïde de la mouche de l'olive[19]. Il parasite également la teigne Tischeria ekelbladella (sur Chêne vert), le coléoptère Apion croceifemoratum (sur Anagyris foetida), les mineuses Phyllocnisis citrella (sur Citrus spp.), Phyllonorycter millierella (sur Micocoulier) et Lithocolletis blancardella (sur Pommier).
Psyttalia (=Opius) concolor parasite également la mouche de la capre (Capparimyia savastani) sur le câprier (Capparis spinosa) et la mouche de la jujube (Carpomyia incompleta) sur le jujubier (Zizyphus vulgaris). Ces espèces sont à introduire dans les haies des oliveraies.
Eupelmus urozonus parasite également Myopites stylata, une petite mouche qui forme des galles sous les inflorescences de l'Inule visqueuse (Inula viscosa), une plante vivace de la famille des Asteracées (=Composées). Ce parasitisme se fait en hiver, ce qui augmente la présence d'Eupelmus urozonus en été pour parasiter très efficacement la mouche d'olive[20].
Des nombreuses Astéracées présentent des intérêts écologiques, car elles sont parasitées par un petit diptère (Acanthiophilus helianthi) de la même famille que la mouche de l'olive (Ricci, Circiofolo, 1983), ce qui ajoute un hôte potentiel pour les auxiliaires de la mouche de l'olive. C'est notamment le cas du carthame (Carthamus oxyacantus, C. glaucus), du chardon cnicaut béni (Cnicus benedictus), de la silybe de Marie (Silybum marianum), du laiteron maraîcher (Sonchus oleaceus), de l'artichaut (Cynara cardunculus), de l'atractyle (Atractylis carduus) ou des centaurées (Centaurea cyanus, C. moschata, C. americana, C. iberica, C. calcitrapa) (F. Warlop 2005).
Dans la lutte contre la mouche de l'olive, c'est tout l'écosystème qui doit être pris en considération, avec la flore et la faune du sol où hiverne Bactrocera.
Lutte transgénique
L'entreprise britannique Oxitec a mis au point une mouche transgénique, nom de code : OX3097D-Bol. « Leur stratégie vise à disséminer des grandes quantités de ces insectes transgéniques pour qu’ils s’accouplent avec leurs homologues naturels et ainsi, tenter de diminuer la prolifération de la population en diminuant son taux de reproduction », explique Inf'OGM dans un article[21] consacré à ce moyen de lutte. Oxitec a demandé à deux reprises l'autorisation pour lâcher des millions de mouches OGM dans un champ de 1 000 m2 sous filet, vers Tarragona en Espagne.
Notes et références
- A. Siciliano (AFIDOL). Mouche de l'olive : notes de cours. Conférences techniques, Montpellier, 1/12/2014
- Diptères : anatomie des mouches
- voir Nathalie Moutier et al., p. 68
- voir Nathalie Moutier et al., p. 48
- voir Nathalie Moutier et al., p. 88
- D'après l'AFIDOL : AFIDOL : mouche de l'olive
- Yoshitomo Kikuchi, Masahito Hayatsu, Takahiro Hosokawa, Atsushi Nagayama Kanako Tago and Takema Fukatsu. Symbiont-mediated insecticide resistance. Nancy A. Moran, Yale University, West Haven, CT, March 30, 2012 (received for review January 5, 2012), 5 p., 5 fig.
- Gleosporium olivarum Mycobank
- voir Le Figaro : Prunes, raisins, etc
- Voir PDF : Cuivre, questions-réponses
- Voir p. 19 in La mouche tsé-tsé pédagogique. Collection les Savoirs partagés. CIRAD, Délégation aux productions pédagogiques innovantes (Montpellier), 2004, 55 p. (ISBN 2-87614-585-5). ISSN 1620-0705.
- op. cit. Lecomte (2015)
- op. cit. Lecomte (p. 38-61
- op. cit. Lecomte (p. 62-87
- op. cit. Lecomte (p. 88-102
- op. cit. Lecomte (p. 108-134
- op. cit. Lecomte (p. 135-169
- voir François Warlop (2006) p. 454
- voir F. Warlopp (2006) p. 451&454
- voir F. Warlop (2005)
- Association Inf'OGM, « ESPAGNE - Une mouche OGM pour sauver les oliviers ? », sur www.infogm.org (consulté le )
Voir aussi
Articles connexes
Bibliographie
- Raymond Gimilio, « L'inule visqueuse et la lutte biologique en oléiculture », Ann. Sté. Horti. et Hist. Nat. Hérault, vol. 150, , p. 70-76
- Sol Franco-Mican et al. (trad. Raymond Gimilio), « Observation du complexe parasitaire de l'Inule visqueuse en Espagne et ses méthodes de propagation », Le Nouvel Olivier, vol. 66, , p. 4-7
- Jean Lecomte (photogr. Jean Lecomte), Lutter naturellement contre la Mouche de l'Olive, Saint-Rémy de Provence, édisud, coll. « Le choix durable », , 216 p., 17x23 (ISBN 978-2-7449-1004-3, www.edisud.com)
- Nathalie Moutier et al., Identification et caractéristiques des variétés d'olivier cultivées en France, t. I, Turriers, Naturalia publications, , 248 p. (ISBN 2-909717-43-7)
- (en) M. Gebiolaa et al., « Pnigalio agraules (Walker) and Pnigalio mediterraneus Ferrière and Delucchi (Hymenoptera: Eulophidae): two closely related valid species », Journal of Natural History, vol. 43, , p. 2465-2480
- François Warlop, « Limitation des populations de ravageurs de l'olivier par le recours à la lutte biologique par conservation », Cahiers Agricultures, vol. 5, , p. 449-455
- (en) Bigler, F., Neuenschwander, P., Delucchi, V., Michelakis, S., « Natural enemies of preimaginal stages of Dacus oleae Gmel. (Diptera: Tephritidae) in western Crete. II. Impact on olive fly populations », Bollettino del Laboratorio di Entomologia Agraria 'Filippo Silvestri', Portici, vol. 43, , p. 79-96.
Liens externes
Références taxonomiques
- (en) Référence Animal Diversity Web : Bactrocera oleae (consulté le )
- (en) Référence Catalogue of Life : Bactrocera (Daculus) oleae (Rossi, 1790) (consulté le )
- (en) Référence Fauna Europaea : Bactrocera (Daculus) oleae (Gmelin, 1790) (consulté le )
- (fr+en) Référence GBIF : Bactrocera oleae (Rossi, 1790) (consulté le )
- (fr+en) Référence ITIS : Bactrocera oleae (Rossi, 1790) (consulté le )
- (en) Référence NCBI : Bactrocera oleae (taxons inclus) (consulté le )
- (fr) Référence INPN : Bactrocera oleae (Rossi, 1790) (TAXREF)