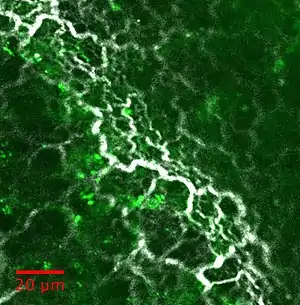
Microscopie de seconde harmonique
La microscopie de seconde harmonique (M2H ou (en) SHIM), aussi appelée « microscopie par génération de seconde harmonique » est basée sur un effet optique non-linéaire connu sous le nom de génération de seconde harmonique (GSH, (en) SHG): on la nomme ainsi souvent "microscopie SHG". Elle a été établie comme un mécanisme de contraste d'imagerie par microscope, utile pour la visualisation de la structure de certains tissus biologiques ou fonctions cellulaire[1], mais aussi de certains cristaux ferroélectriques[2].
Un microscope SHG produit des images dont le contraste est dû aux variations de la capacité d'un échantillon à générer de la lumière d'harmonique deux à partir de la lumière incidente, tandis qu'un microscope optique classique obtient son contraste en détectant les variations de densité optique, de la longueur du trajet ou de l'indice de réfraction optique du spécimen. La SHG requiert une lumière laser intense traversant un matériau de structure moléculaire non-centrosymétrique (qui ne possède pas de centre de symétrie). La lumière SHG émergeant d'un tel matériau correspond exactement à la moitié de la longueur d'onde (fréquence doublée) de la lumière pénétrant dans le matériau. Bien que la microscopie par excitation à deux photons (2PEF) soit également un processus à deux photons, la 2PEF perd de l'énergie lors de la relaxation de l'état excité, alors que la SHG conserve l'énergie. Généralement, un cristal inorganique est utilisé pour produire de la lumière SHG, mais certains matériaux biologiques peuvent être hautement polarisables et s'assembler en grandes structures non centrosymétriques assez ordonnées (longs filaments à symétrie cylindrique). Les matériaux biologiques tels que le collagène, les microtubules (via la tubuline) et les muscles (via la myosine[3]) peuvent produire des signaux de SHG.
La conversion de SHG est généralement déterminée par la condition accord de phase (en). Une configuration courante pour un système d'imagerie SHG comprendra un microscope à balayage laser avec un laser titane-sapphire à blocage de mode comme source d'excitation. Le signal SHG se propage généralement dans le sens direct (celui de la lumière d'excitation), et la détection est alors faite en transmission. Cependant, du signal est aussi émis dans la direction inverse (« épi »), et le signal peut alors également être mesuré en « réflexion » : ceci peut être utile pour des matériaux opaques, ou épais, et une partie de ce signal peut être due à la rétroréflexion du signal émis vers l'avant[4].
Avantages
La microscopie SHG offre plusieurs avantages pour l'imagerie de cellules vivantes et des tissus : elle n’implique pas l’excitation de molécules, contrairement à d’autres techniques telles que la microscopie de fluorescence. Par conséquent, les molécules ne subissent pas d'effets de phototoxicité ou de photoblanchiment. De plus, comme de nombreuses structures biologiques produisent des signaux SHG assez puissants, il n'est pas nécessaire de marquer les molécules avec des marqueurs exogènes (ce qui pourrait modifier le fonctionnement d'un système biologique): cette technique est donc minimalement invasive. En utilisant des longueurs d'onde dans le proche infrarouge pour la lumière incidente, la microscopie SHG a la capacité de construire des images de spécimens en trois dimensions en effectuant une imagerie plus profonde dans des tissus épais.
Différence et complémentarité avec la fluorescence à deux photons (2PEF)
La fluorescence à deux photons (2PEF) est un processus très différent de la SHG: elle implique une excitation d'électrons vers des niveaux d'énergie plus élevés, et une désexcitation subséquente par émission d'un photon (contrairement à la SHG, bien qu'elle soit aussi un processus à 2 photons). Ainsi, la 2PEF est un processus non cohérent, spatialement (émission isotrope) et temporellement (large spectre, dépendant de l'échantillon). Elle n'est pas non plus spécifique à certaines structures, contrairement à la SHG[5].
La 2PEF peut donc être couplée à la SHG en imagerie multiphotonique pour révéler certaines molécules qui produisent de l'autofluorescence, telle que l'élastine dans les tissus (alors que la SHG révèle le collagène ou la myosine par exemple).
Historique
En 1971, Fine et Hansen ont rapporté la première observation de SHG à partir d'échantillons de tissus biologiques[6]. En 1974, Hellwarth et Christensen ont rapporté pour la première fois la microscopie SHG de ZnSe polycristallins[7], puis en 1977, Colin Sheppard a imagé divers cristaux de SHG avec un microscope optique à balayage. La SHG a été utilisée en imagerie biologique pour la 1re fois en 1979 par Roth&Freund pour imager le collagène, et plus spécifiquement en 1985 dans du tendon de queue de rat[8], bien que ces avancées aient passé inaperçues dans le domaine de la microscopie optique à l'époque[2]. En 1993, Lewis a examiné la réponse en SHG de colorant styryl en présence d'un champ électrique, mais aussi l'imagerie de cellules vivantes. Le miscroscope de fluorescence à deux photons plein-champ (sans balayage) a été publié en 1996[9] , et aurait pu servir à imager de la SHG. La microscopie SHG a ensuite été utilisée pour l'observation de l'amidon de plantes[10] - [11] des mégamolécules[12], de la soie d'araignée[13] - [14] etc. En 2010, la SHG a été étendue à l'imagerie [in vivo] de petits animaux entiers[15] - [16]. En 2019, les applications se sont élargies en appliquant la SHG à l’imagerie sélective de produits agrochimiques directement sur la surface des feuilles, afin d’évaluer l’efficacité des pesticides[17].
Analyse quantitative
Anisotropie orientationnelle
L'anisotropie de la polarisation en SHG peut être utilisée pour déterminer l’orientation et le degré d’organisation des protéines dans les tissus, puisque les signaux SHG ont des polarisations bien définies. En utilisant l'équation d'anisotropie[18]:
et en acquérant les intensités des polarisations dans les directions parallèle et perpendiculaire au plan du laboratoire (convention), on peut calculer . Un élevé indique une orientation plutôt anisotrope, tandis qu'une valeur de faible indique une structure isotrope. Dans les travaux menés par Campagnola et Loew[18], il a été constaté que les fibres de collagène formaient des structures bien alignées avec .
Rapport avant sur arrière F/B
La SHG étant un processus cohérent ( spatialement et temporellement), il conserve des informations sur la direction de l'excitation et n'est pas émis de manière isotrope. Elle est principalement émise vers l'avant (forward, comme pour l'excitation), mais peut également être émise vers l'arrière (backward) en fonction de la condition d'accord de phase. En effet, la longueur de cohérence au-delà de laquelle conversion du signal diminue est:
avec pour le forward, mais pour le backward si bien que >> . Par conséquent, des structures plus épaisses seront visibles préférentiellement vers l'avant (forward), et les plus minces vers l'arrière (backward): puisque la conversion de la SHG dépend en première approximation du carré du nombre d'harmonophores, le signal sera plus élevé s'il est émis par des structures épaisses, donc le signal avant sera supérieur au signal arrière. Cependant, le tissu peut diffuser la lumière générée et une partie de la SHG vers l'avant peut être rétroréfléchie vers l'arrière[19].
Ensuite, le rapport avant/arrière F/B peut être calculé[19], et est une métrique de la taille globale et de la disposition des harmonophores (généralement des fibrilles de collagène). On peut également montrer que plus l'angle hors-plan du diffuseur est élevé, plus son rapport F/B est élevé (voir fig. 2.14 of[20]).
SHG résolue en polarisation (p-SHG)
Les avantages de polarimétrie ont été couplés à la SHG en 2002 par Stoller et al[21]. La polarimétrie sert à mesurer l'orientation et l'ordre au niveau moléculaire, et couplée à la SHG, elle peut le faire avec une spécificité à certaines structures comme le collagène : la microscopie SHG résolue en polarisation (p-SHG) est donc une extension de la microscopie SHG[22]. La p-SHG définie un autre paramètre d'anisotropie tel que[23]:
qui est, comme r, une mesure de l'orientation principale et du désordre de la structure imagée. Comme elle est souvent réalisée dans de longs filaments cylindriques (comme le collagène), cette anisotropie est souvent égale à [24], où est la susceptibilité électrique non-linéaire et X la direction du filament (ou la direction principale de la structure), Y est orthogonal à X et Z est la direction de propagation de la lumière d'excitation.
L'orientation ϕ des filaments dans le plan XY de l'image peut également être extraite grâce à la p-SHG par une analyse FFT, et utilisée comme un contraste sur une image[24] - [25].
Quantification de la fibrose
Le collagène (cas particulier, mais largement étudié en microscopie SHG), peut exister sous différentes formes : 28 types différents, dont 5 fibrillaires. L'un des défis consiste à caractériser et à quantifier le collagène fibrillaire dans un tissu, pour pouvoir voir son évolution et sa relation avec d'autres composantes du tissu[26].
Pour cela, une image de microscopie SHG doit être corrigée pour éliminer la petite quantité de fluorescence ou de bruit résiduel qui existe à la longueur d'onde SHG. Après cela, un masque numérique peut être appliqué pour quantifier le collagène à l'intérieur de l'image[26]. Parmi les différentes techniques de quantification, c'est probablement celle qui a la spécificité, la reproductibilité et l'applicabilité la plus élevée, bien qu'elle soit assez complexe[26].
Autres
La microscopie SHG a également été utilisée pour montrer que les potentiels d'action se propageant en sens inverse entrent dans les épines dendritiques sans atténuation de tension, établissant ainsi une base solide pour des travaux futurs sur l'imagerie des neurones par SHG. L'avantage ici est la mesure de tension dans les dendrites avec une précision inaccessible avec la microscopie standard à deux photons[27].
Matériaux imageables

La microscopie SHG et ses extensions peuvent être utilisées pour étudier divers tissus: quelques exemples d'images sont rapportés dans la figure ci-dessous: le collagène à l'intérieur de la matrice extra-cellulaire reste la principale application. On le retrouve dans les tendons, la peau, les os, la cornée, les artères, le fascia, le cartilage, le ménisque, les disques intervertébraux...
La myosine peut également être imagée par SHG : dans le muscle squelettique, le muscle cardiaque.
En outre, la SHG peut convertir efficacement la lumière proche infrarouge en lumière visible pour permettre une thérapie photodynamique guidée par imagerie, surmontant ainsi les limitations de profondeur de pénétration[28] - [29].
| Type | Matériau | Présent dans | signal SHG | Spécificité |
|---|---|---|---|---|
| Glucide | Cellulose | Bois, Plante verte, algue. | Assez faible dans la cellulose normale[17], mais assez fort dans la cellulose cristalline ou nanocristalline. | - |
| Amidon | Aliments de base, plante verte | Signal assez intense[30] | la chiralité est au niveau micro et macro, et la SHG est différente si la polarisation d'excitation est circulaire droite ou gauche | |
| Megamolécule polysaccharide de sacran | Cyanobacterie | À partir de morceaux, de fibres et de films de sacran | le signal des films est le plus faible[12] | |
| Protéine | Fibroïne et séricine | Soie d'araignée | Plutôt faible | [13] |
| Collagène[8] | tendon, peau, os, cornée, artères, fascia, cartilage, ménisque, disques intervertébraux ; tissus conjonctifs | Assez fort, dépend du type de collagène (forme-t-il des fibrilles, des fibres?) | Les composantes du tenseur de susceptibilité non-linéaire sont , , , avec ~ et / ~ 1.4 dans la plupart des cas | |
| Myosine | muscle squelettique ou cardiaque[3] | Assez fort | Les composantes du tenseur de susceptibilité non-linéaire sont , , avec ~ mais / ~ 0.6 < 1 contrairement au collagène | |
| Tubuline | Microtubules durant la mitose ou la meiose[31], ou dans les dendrites des neurones[32] | Assez faible | Les microtubules doivent être alignés pour générer efficacement | |
| Minéraux | Cristaux piézoélectriques | Aussi appelés cristaux non-linéaires | Fort si accord de phase | Différent accord de phase : types, critique ou non-critique |
Couplage avec la microscopie THG
La microscopie de Génération de troisième harmonique (THG) peut être complémentaire de la microscopie SHG, car elle est sensible aux interfaces transverses et à la susceptibilité non linéaire du 3e ordre [33] - [34].
Applications
Cancer, caractérisation des tumeurs
La densité mammographique est corrélée avec celle du collagène : la microscopie SHG peut donc servir à identifier le cancer du sein[35]. La SHG est généralement couplée à d'autres techniques non linéaires telles que la microscopie CARS (en) ou la microscopie deux photons, pour former la microscopie multiphotonique (ou tomographie) qui fournit un diagnostic in vivo non invasif et rapide (comme l'histologie) de biopsies pouvant être cancéreuses[36].
Cancer du sein
La comparaison des images SHG avant et arrière donne un aperçu de la microstructure du collagène, elle-même liée à la gravité et au stade d'une tumeur[37]. La comparaison des images SHG et de microscopie deux photons (autofluorescence) peuvent aussi montrer le changement d'orientation du collagène dans les tumeurs[38].
Même si la microscopie SHG a beaucoup contribué à la recherche sur le cancer du sein, elle n'est pas encore établie comme une technique fiable en médecine ou pour le diagnostic de pathologies en général[37].
Cancer des ovaires
Les ovaires saines présentent une SHG uniforme dans leur couche épithéliale et un collagène bien organisé dans leur stroma, alors que l'épithélium aura de grandes cellules et une structure de collagène modifiée dans les ovaires cancéreuses[37]. Le ratio r (voir anisotropie d'orientation) est aussi utilisé[39] pour montrer que l'alignement des fibrilles est légèrement plus élevé pour les tissus cancéreux que pour les tissus normaux.
Cancer de la peau
La SHG est, encore ici, combinée à la microscopie deux photons pour calculer le ratio :
où shg (resp. tpef) est le nombre de pixels dépassant un certain seuil (en intensité) dans l'image SHG (resp. 2PEF de fluorescence)[40], un MFSI élevé signifiant une image SHG pure (sans fluorescence). Le MFSI le plus élevé est mesuré pour les tissus cancéreux[37], ce qui fournit un mode de contraste pour les différencier des tissus normaux.
La SHG a également été combinée à génération de troisième harmonique (THG) pour montrer que le signal epi-THG (voir rapport F/B) est plus élevé dans les tumeurs[41].
Autres cancers
La SHG a été utilisée pour l'étude des cancers du poumon, du côlon, du stroma œsophagien, du col utérin et du pancréas[37].
Détection de pathologies
Des altérations de l'organisation ou de la polarité des fibrilles de collagène peuvent être des signes directs de pathologie[42] - [43].
En particulier, l'anisotropie d'alignement des fibres de collagène a permis de discriminer le derme sain de cicatrices pathologiques dans des échantillons de peau[44]. De plus, les pathologies du cartilage telles que l'arthrose peuvent être sondées par microscopie SHG résolue en polarisation[45] - [46]. La SHIM a ensuite été étendue au fibrocartilage (ménisque)[47].
Ingénierie des tissus
La capacité de la SHG à imager des molécules spécifiques peut servir à révéler la structure de certains tissus une seule composante à la fois, et à différentes échelles (de macro à micro) en utilisant la microscopie. Par exemple, le collagène (type I) est spécifiquement imagé à partir de la matrice extracellulaire (ECM) des cellules, ou lorsqu'il sert de matériau conjonctif dans les tissus[48]. La microscopie SHG révèle également la fibroïne dans la soie, la myosine dans les muscles et la cellulose biosynthétisée. Toutes ces capacités d'imagerie peuvent être utilisées pour concevoir des tissus artificiels, en ciblant des points spécifiques du tissu : la SHG peut en effet servir à mesurer quantitativement certaines orientations, ainsi que la quantité et l'arrangement des matériaux[48]. De plus, la SHG couplée à d'autres techniques multiphotons peut servir à surveiller le développement de tissus synthétiques, lorsque l'échantillon est relativement mince cependant[49]. Bien entendu, ces techniques peuvent enfin être utilisés comme contrôle qualité des tissus fabriqués[49].
Structure de l'œil
La cornée, à la surface de l'œil, est considérée comme étant constituée d'une structure de collagène semblable à un assemblage en couches, en raison des propriétés d'auto-organisation du collagène dense[50]. Pourtant, l'orientation cornéale du collagène en lamelles fait encore débat[51].
Le kératocône cornéen peut également être visualisé par microscopie SHG pour révéler des altérations morphologiques du collagène[52]. La microscopie par génération de troisième harmonique (THG) est en outre utilisée pour imager la cornée, qui est complémentaire au signal SHG car les maxima THG et SHG dans ce tissu sont souvent à des endroits différents[53].
Voir aussi
Sources
- Michael Schmitt, Thomas Mayerhöfer, Jürgen Popp, Ingo Kleppe et Klaus Weisshartannée, Handbook of Biophotonics, Chap.3 Light–Matter Interaction, Wiley, (ISBN 978-3-527-64398-1, DOI 10.1002/9783527643981.bphot003, lire en ligne)
- Francesco S. Pavone et Paul J. Campagnola, Second Harmonic Generation Imaging, 2nd edition, CRC Taylor&Francis, , 476 p. (ISBN 978-1-4398-4914-9, lire en ligne)
- Paul J. Campagnola, Heather A. Clark, William A. Mohler, Aaron Lewis et Leslie M. Loew, « Second harmonic imaging microscopy of living cells », Journal of Biomedical Optics, vol. 6, no 3, , p. 277–286 (PMID 11516317, DOI 10.1117/1.1383294, Bibcode 2001JBO.....6..277C, hdl 2047/d20000323, lire en ligne)
- Paul J. Campagnola et Leslie M Loew, « Second-harmonic imaging microscopy for visualizing biomolecular arrays in cells, tissues and organisms », Nature Biotechnology, vol. 21, no 11, , p. 1356–1360 (PMID 14595363, DOI 10.1038/nbt894, lire en ligne)
- P. Stoller, K.M. Reiser, P.M. Celliers et A.M. Rubenchik, « Polarization-modulated second harmonic generation in collagen », Biophys. J., vol. 82, no 6, , p. 3330–3342 (PMID 12023255, PMCID 1302120, DOI 10.1016/s0006-3495(02)75673-7, Bibcode 2002BpJ....82.3330S)
- M. Han, G. Giese et J. F. Bille, « Second harmonic generation imaging of collagen fibrils in cornea and sclera », Opt. Express, vol. 13, no 15, , p. 5791–5797 (PMID 19498583, DOI 10.1364/opex.13.005791, Bibcode 2005OExpr..13.5791H)
- Karsten König, Multiphoton Microscopy and Fluorescence Lifetime Imaging : Applications in Biology and Medicine, De Gruyter, , 450 p. (ISBN 978-3-11-042998-5, lire en ligne)

- Adib Keikhosravi, Jeremy S. Bredfeldt, Abdul Kader Sagar et Kevin W. Eliceiri, « Second-harmonic generation imaging of cancer (in "Quantitative Imaging in Cell Biology" par Jennifer C. Waters, Torsten Wittman) », Elsevier, vol. 123, , p. 531–546 (DOI 10.1016/B978-0-12-420138-5.00028-8, lire en ligne)
- Hanry Yu et Nur Aida Abdul Rahim, Imaging in Cellular and Tissue Engineering, 1st edition, CRC Taylor&Francis, (ISBN 978-0-367-44586-7, lire en ligne)
- Riccardo Cicchi, Nadine Vogler, Dimitrios Kapsokalyvas, Benjamin Dietzek, Jürgen Popp et Francesco Saverio Pavone, « From molecular structure to tissue architecture: collagen organization probed by SHG microscopy », Journal of Biophotonics, vol. 6, no 2, , p. 129–142 (DOI 10.1002/jbio.201200092)

Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Second-harmonic_imaging_microscopy » (voir la liste des auteurs).
- Juan Carlos Stockert, Alfonso Blázquez-Castro, Fluorescence Microscopy in Life Sciences, Bentham Science Publishers, , 642–686 p. (ISBN 978-1-68108-519-7, lire en ligne), « Chapter 19 Non-Linear Optics »
- Francesco S. Pavone et Paul J. Campagnola, Second Harmonic Generation Imaging, 2nd edition, CRC Taylor&Francis, , 476 p. (ISBN 978-1-4398-4914-9, lire en ligne)
- V. Nucciotti, C. Stringari, L. Sacconi, F. Vanzi, L. Fusi, M. Linari, G. Piazzesi, V. Lombardi et F. S. Pavone, « Probing myosin structural conformation in vivo by second-harmonic generation microscopy », Proceedings of the National Academy of Sciences, vol. 107, no 17, , p. 7763–7768 (ISSN 0027-8424, DOI 10.1073/pnas.0914782107)
- Michael Schmitt, Thomas Mayerhöfer, Jürgen Popp, Ingo Kleppe et Klaus Weisshartannée, Handbook of Biophotonics, Chap.3 Light–Matter Interaction, Wiley, (ISBN 978-3-527-64398-1, DOI 10.1002/9783527643981.bphot003, lire en ligne)
- Xiyi Chen et P.J. Campagnola, Second Harmonic Generation Imaging, 2nd edition, CRC Taylor&Francis, , 476 p. (ISBN 978-1-4398-4914-9, lire en ligne), « SHG Microscopy and Its Comparison with THG, CARS, and Multiphoton Excited Fluorescence Imaging »
- Fine, S. et Hansen, W. P., « Optical second harmonic generation in biological systems », Applied Optics, vol. 10, no 10, , p. 2350–2353 (PMID 20111328, DOI 10.1364/AO.10.002350, Bibcode 1971ApOpt..10.2350F)
- Hellwarth, Robert et Christensen, Paul, « Nonlinear optical microscopic examination of structure in polycrystalline ZnSe », Optics Communications, vol. 12, no 3, , p. 318–322 (DOI 10.1016/0030-4018(74)90024-8, Bibcode 1974OptCo..12..318H)
- Warren R. Zipfel, Rebecca M. Williams et Watt W. Webb, « Nonlinear magic: Multiphoton microscopy in the biosciences », Nature Biotechnology, vol. 21, no 11, , p. 1369-1377 (DOI 10.1038/10.1038/nbt899)
- G.J. Brakenhoff, Y. Sonoda, J. Squier, T. Norris, A.C. Bliton, M.H. Wade et B. Athey, « Real-time two-photon confocal microscopy using afemtosecond, amplified Tisapphire system », Journal of Microscopy, vol. 181, no 3, , p. 253-259 (DOI 10.1046/j.1365-2818.1996.97379.x)
- G. Mizutani, Y. Sonoda, H. Sano, M. Sakamoto, T. Takahashi et S. Ushioda, « Detection of starch granules in a living plant by optical second harmonic microscopy », Journal of Luminescence, vol. 87, , p. 824–826 (DOI 10.1016/S0022-2313(99)00428-7, Bibcode 2000JLum...87..824M)
- Yue Zhao, Shogo Takahashi, Yanrong Li, K. T. T. Hien, Akira Matsubara, Goro Mizutani et Yasunori Nakamura, « Ungerminated Rice Grains Observed by Femtosecond Pulse Laser Second-Harmonic Generation Microscopy », J. Phys. Chem. B, vol. 122, no 32, , p. 7855–7861 (DOI 10.7566/JPSJ.86.124401, arXiv 1808.05449, lire en ligne)
- Yue Zhao, Khuat Thi Thu Hien, Goro Mizutani, Harvey N. Rutt, Kittima Amornwachirabodee, Maiko Okajima et Tatsuo Kaneko, « Optical second-harmonic images of sacran megamolecule aggregates », Journal of the Optical Society of America A, vol. 34, no 2, , p. 146–152 (DOI 10.1364/JOSAA.34.000146, Bibcode 2017JOSAA..34..146Z, arXiv 1702.07165)
- Yue Zhao, Khuat Thi Thu Hien, Goro Mizutani et Harvey N. Rutt, « Second-order nonlinear optical microscopy of spider silk », Applied Physics B, vol. 123, no 6, , p. 188 (DOI 10.1007/s00340-017-6766-z, Bibcode 2017ApPhB.123..188Z, arXiv 1706.03186)
- Yue Zhao, Yanrong Li, K. T. T. Hien, Goro Mizutani et Harvey N. Rutt, « Observation of Spider Silk by Femtosecond Pulse Laser Second Harmonic Generation Microscopy », Surf. Interface Anal., vol. 51, no 1, , p. 50–56 (DOI 10.1002/sia.6545, arXiv 1812.10390)
- B. E. Cohen, « Biological imaging: Beyond fluorescence », Nature, vol. 467, no 7314, , p. 407–8 (PMID 20864989, DOI 10.1038/467407a, Bibcode 2010Natur.467..407C)
- P. Pantazis, J. Maloney, D. Wu et S. Fraser, « Second harmonic generating (SHG) nanoprobes for in vivo imaging », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 33, , p. 14535–14540 (PMID 20668245, PMCID 2930484, DOI 10.1073/pnas.1004748107, Bibcode 2010PNAS..10714535P)
- Benjamin Grubbs, Nicholas Etter, Wesley Slaughter, Alexander Pittsford, Connor Smith et Paul Schmitt, « A Low-Cost Beam-Scanning Second Harmonic Generation Microscope with Application for Agrochemical Development and Testing », Analytical Chemistry, vol. 91, no 18, , p. 11723-11730 (DOI 10.1021/acs.analchem.9b02304)
- Paul J Campagnola et Leslie M Loew, « Second-harmonic imaging microscopy for visualizing biomolecular arrays in cells, tissues and organisms », Nature Biotechnology, vol. 21, no 11, , p. 1356–1360 (ISSN 1087-0156, DOI 10.1038/nbt894)
- Xiyi Chen, Oleg Nadiarynkh, Sergey Plotnikov et Paul J Campagnola, « Second harmonic generation microscopy for quantitative analysis of collagen fibrillar structure », Nature Protocols, vol. 7, no 4, , p. 654–669 (ISSN 1754-2189, DOI 10.1038/nprot.2012.009)
- Riccardo Cicchi, Leonardo Sacconi, Francesco Vanzi et Francesco S. Pavone, "How to Build an SHG Apparatus" in Second Harmonic Generation Imaging, 2nd edition, CRC Taylor&Francis, , 476 p. (ISBN 978-1-4398-4914-9, lire en ligne)
- P. Stoller, K. Reiser, P. Celliers et A. Rubenchik, « Polarization-modulated second harmonic generation in collagen », Biophys. J., vol. 82, , p. 3330-3342 (DOI 10.1016/S0006-3495(02)75673-7)
- Julien Duboisset, Dora Aït-Belkacem, Muriel Roche, Hervé Rigneault et Sophie Brasselet, « Generic model of the molecular orientational distribution probed by polarization-resolved second-harmonic generation », Physical Review A, vol. 85, no 4, (ISSN 1050-2947, DOI 10.1103/PhysRevA.85.043829)
- Claire Teulon, Ivan Gusachenko, Gaël Latour et Marie-Claire Schanne-Klein, « Theoretical, numerical and experimental study of geometrical parameters that affect anisotropy measurements in polarization-resolved SHG microscopy », Optics Express, vol. 23, no 7, , p. 9313 (ISSN 1094-4087, DOI 10.1364/OE.23.009313)
- Ivan Gusachenko, Viet Tran, Yannick Goulam Houssen, Jean-Marc Allain et Marie-Claire Schanne-Klein, « Polarization-Resolved Second-Harmonic Generation in Tendon upon Mechanical Stretching », Biophysical Journal, vol. 102, no 9, , p. 2220–2229 (ISSN 0006-3495, DOI 10.1016/j.bpj.2012.03.068)
- Nirmal Mazumder, Gitanjal Deka, Wei-Wen Wu, Ankur Gogoi, Guan-Yu Zhuo et Fu-Jen Kao, « Polarization resolved second harmonic microscopy », Methods, vol. 128, , p. 105–118 (ISSN 1046-2023, DOI 10.1016/j.ymeth.2017.06.012)
- Marie-Claire Schanne-Klein, "SHG Imaging of Collagen and Application to Fibrosis Quantization" in Second Harmonic Generation Imaging, 2nd edition, CRC Taylor&Francis, , 476 p. (ISBN 978-1-4398-4914-9, lire en ligne)
- Mutsuo Nuriya, Jiang Jiang, Boaz Nemet, Kenneth B. Eisenthal et Rafael Yuste, « Imaging membrane potential in dendritic spines », PNAS, vol. 103, no 3, , p. 786–790 (PMID 16407122, PMCID 1334676, DOI 10.1073/pnas.0510092103, Bibcode 2006PNAS..103..786N)
- Bobo Gu, Artem Pliss et Andrey N. Kuzmin, « In-situ second harmonic generation by cancer cell targeting ZnO nanocrystals to effect photodynamic action in subcellular space », Biomaterials, vol. 104, , p. 78–86 (PMID 27442221, DOI 10.1016/j.biomaterials.2016.07.012)
- . Erich E. Hoover et Jeff A. Squier, « Advances in multiphoton microscopy technology (review) », Nature Photonics, vol. 7, no 2, , p. 93-101 (DOI 10.1038/nphoton.2012.361)
- Sotiris Psilodimitrakopoulos, Ivan Amat-Roldan, Pablo Loza-Alvarez et David Artigas, « Estimating the helical pitch angle of amylopectin in starch using polarization second harmonic generation microscopy », Journal of Optics, vol. 12, no 8, , p. 084007 (ISSN 2040-8978, DOI 10.1088/2040-8978/12/8/084007)
- Francesco S. Pavone et P.J. Campagnola, Second Harmonic Generation Imaging, 2nd edition, CRC Taylor&Francis, , 476 p. (ISBN 978-1-4398-4914-9, lire en ligne)
- V. Van Steenbergen, W. Boesmans, Z. Li, Y. de Coene, K. Vints, P. Baatsen, I. Dewachter, M. Ameloot, K. Clays et P. Vanden Berghe, « Molecular understanding of label-free second harmonic imaging of microtubules », Nature Communications, vol. 10, no 1, (ISSN 2041-1723, DOI 10.1038/s41467-019-11463-8)
- Y. Barad, H. Eisenberg, M. Horowitz et Y. Silberberg, « Nonlinear scanning laser microscopy by third harmonic generation », Applied Physics Letters, vol. 70, no 8, , p. 922–924 (ISSN 0003-6951, DOI 10.1063/1.118442)
- N. Olivier, M. A. Luengo-Oroz, L. Duloquin, E. Faure, T. Savy, I. Veilleux, X. Solinas, D. Debarre, P. Bourgine, A. Santos, N. Peyrieras et E. Beaurepaire, « Cell Lineage Reconstruction of Early Zebrafish Embryos Using Label-Free Nonlinear Microscopy », Science, vol. 329, no 5994, , p. 967–971 (ISSN 0036-8075, DOI 10.1126/science.1189428)
- Salem Alowami, Sandra Troup, Sahar Al-Haddad, Iain Kirkpatrick et Peter H Watson, « Mammographic density is related to stroma and stromal proteoglycan expression », Breast Cancer Research, vol. 5, no 5, (ISSN 1465-542X, DOI 10.1186/bcr622)
- Karsten König, "Multiphoton Tomography (MPT)" Chap.13 in Multiphoton Microscopy and Fluorescence Lifetime Imaging : Applications in Biology and Medicine, De Gruyter, , 450 p. (ISBN 978-3-11-042998-5, lire en ligne)
- Adib Keikhosravi, Jeremy S. Bredfeldt, Abdul Kader Sagar et Kevin W. Eliceiri, « Second-harmonic generation imaging of cancer (from "Quantitative Imaging in Cell Biology by Jennifer C. Waters, Torsten Wittman") », Elsevier, vol. 123, , p. 531–546 (ISSN 0091-679X, DOI 10.1016/B978-0-12-420138-5.00028-8, lire en ligne)
- Paolo P Provenzano, Kevin W Eliceiri, Jay M Campbell, David R Inman, John G White et Patricia J Keely, « Collagen reorganization at the tumor-stromal interface facilitates local invasion », BMC Medicine, vol. 4, no 38, (DOI 10.1186/1741-7015-4-38)
- Oleg Nadiarnykh, Ronald B LaComb, Molly A Brewer et Paul J Campagnola, « Alterations of the extracellular matrix in ovarian cancer studied by Second Harmonic Generation imaging microscopy », BMC Cancer, vol. 10, no 1, (ISSN 1471-2407, DOI 10.1186/1471-2407-10-94)
- Sung-Jan Lin, Shiou-Hwa Jee, Chien-Jui Kuo, Ruei-Jr Wu, Wei-Chou Lin, Jau-Shiuh Chen, Yi-Hua Liao, Chih-Jung Hsu, Tsen-Fang Tsai, Yang-Fang Chen et Chen-Yuan Dong, « Discrimination of basal cell carcinoma from normal dermal stroma by quantitative multiphoton imaging », Optics Letters, vol. 31, no 18, , p. 2756 (ISSN 0146-9592, DOI 10.1364/OL.31.002756)
- Szu-Yu Chen, Shee-Uan Chen, Hai-Yin Wu, Wen-Jeng Lee, Yi-Hua Liao et Chi-Kuang Sun, « In Vivo Virtual Biopsy of Human Skin by Using Noninvasive Higher Harmonic Generation Microscopy », IEEE Journal of Selected Topics in Quantum Electronics, vol. 16, no 3, (DOI 10.1109/JSTQE.2009.2031987)
- Karsten König, Multiphoton Microscopy and Fluorescence Lifetime Imaging : Applications in Biology and Medicine, De Gruyter, , 450 p. (ISBN 978-3-11-042998-5, lire en ligne)
- Riccardo Cicchi, « The New Digital Pathology: Just Say NLO », Digestive Diseases and Sciences, vol. 59, no 7, , p. 1347–1348 (ISSN 0163-2116, DOI 10.1007/s10620-014-3165-8)
- Riccardo Cicchi, Nadine Vogler, Dimitrios Kapsokalyvas, Benjamin Dietzek, Jürgen Popp et Francesco Saverio Pavone, « From molecular structure to tissue architecture: collagen organization probed by SHG microscopy », Journal of Biophotonics, vol. 6, no 2, , p. 129–142 (ISSN 1864-063X, DOI 10.1002/jbio.201200092)

- Jessica C. Mansfield, C. Peter Winlove, Julian Moger et Steve J. Matcher, « Collagen fiber arrangement in normal and diseased cartilage studied by polarization sensitive nonlinear microscopy », Journal of Biomedical Optics, vol. 13, no 4, , p. 044020 (ISSN 1083-3668, DOI 10.1117/1.2950318)

- Alvin T. Yeh, Marie J. Hammer-Wilson, David C. Van Sickle, Hilary P. Benton, Aikaterini Zoumi, Bruce J. Tromberg et George M. Peavy, « Nonlinear optical microscopy of articular cartilage », Osteoarthritis and Cartilage, vol. 13, no 4, , p. 345–352 (ISSN 1063-4584, DOI 10.1016/j.joca.2004.12.007)

- Woojin M. Han, Su-Jin Heo, Tristan P. Driscoll, John F. Delucca, Claire M. McLeod, Lachlan J. Smith, Randall L. Duncan, Robert L. Mauck et Dawn M. Elliott, « Microstructural heterogeneity directs micromechanics and mechanobiology in native and engineered fibrocartilage », Nature Materials, vol. 15, no 4, , p. 477–484 (ISSN 1476-1122, DOI 10.1038/nmat4520)
- W.L. Chen et H.S. Lee, Second Harmonic Generation Imaging, 2nd edition, CRC Taylor&Francis, , 476 p. (ISBN 978-1-4398-4914-9, lire en ligne), « SHG Imaging for Tissue Engineering Applications »
- A. Enejder et C. Brackmann, Imaging in Cellular and Tissue Engineering, 1st edition, CRC Taylor&Francis, (ISBN 978-0-367-44586-7, lire en ligne), « Use of Multiphoton Microscopy for Tissue Engineering Applications »
- J.H. Krachmer, M.J. Mannis et E.J. Holland, Cornea, Fundamentals, Diagnosis and Management. 2nd edition, Elsevier Mosby, (ISBN 0-323-02315-0, lire en ligne)
- Juan M. Bueno, Francisco J. Ávila et M. Carmen Martínez-García, « Quantitative Analysis of the Corneal Collagen Distribution after In Vivo Cross-Linking with Second Harmonic Microscopy », BioMed Research International, vol. 2019, , p. 1–12 (ISSN 2314-6133, DOI 10.1155/2019/3860498)
- N. Morishige, R. Shin-gyou-uchi, H. Azumi, H. Ohta, Y. Morita, N. Yamada, K. Kimura, A. Takahara et K.-H. Sonoda, « Quantitative Analysis of Collagen Lamellae in the Normal and Keratoconic Human Cornea by Second Harmonic Generation Imaging Microscopy », Investigative Ophthalmology & Visual Science, vol. 55, no 12, , p. 8377–8385 (ISSN 0146-0404, DOI 10.1167/iovs.14-15348)
- N. Olivier, D. Débarre et E. Beaurepaire, Second Harmonic Generation Imaging, 2nd edition, CRC Taylor&Francis, , 476 p. (ISBN 978-1-4398-4914-9, lire en ligne), « THG Microscopy of Cells and Tissues: Contrast Mechanisms and Applications »