Isotopes de l'hélium
L'hélium (He) (masse atomique standard : 4,002602(2) u) possède huit isotopes connus, mais seulement deux sont stables, l'hélium 3 (3He) et l'hélium 4 (4He). Tous les radioisotopes de l'hélium ont une durée de vie courte, 6He, celui à la durée la plus longue ayant une demi-vie de 806,7 millisecondes. L'isotope le plus courant de l'hélium dans l'atmosphère terrestre est l'hélium 4, la fraction atomique entre les deux isotopes étant de un pour un million[1]. Cependant, l'hélium est assez inhabituel au sens que son abondance isotopique varie grandement en fonction de son origine. Dans le milieu interstellaire, la proportion d'3He est mille fois plus élevée[2]. Les roches de la croûte terrestre ont des ratios d'isotopes variant d'un facteur 10, en fonction de leur origine; ce fait est d'ailleurs utilisé en géologie pour étudier l'origine des roches et la composition du manteau terrestre[3]. Les différents procédés de formations des deux isotopes stables produisent des abondances isotopiques différentes.
Des mélanges à parts égales d'hélium 3 et 4 se séparent en dessous de 0,8 kelvin en deux phases non miscibles à cause de leur dissemblance (les deux isotopes suivent une statistique quantique différente : les atomes d'4He sont des bosons alors que ceux d' 3He sont des fermions)[4]. Les réfrigérateurs à dilution utilisent cette non-miscibilité des deux isotopes pour obtenir des températures de quelques millikelvins.
Tous les isotopes de l'hélium plus lourds que 4He sont instables et se désintègrent avec une demi-vie inférieure à une seconde. Cependant les chercheurs ont créé de nouveaux isotopes grâce à des collisions dans des accélérateurs de particules afin de produire des noyaux inhabituels pour des éléments tels que l'hélium, le lithium ou l'azote. Les structures nucléaires étranges de ces isotopes permettent d'avoir un autre regard sur les propriétés isolées des neutrons.
Hélium 2 (diproton)
L'hélium 2 (2He) est un isotope hypothétique de l'hélium dont le noyau serait constitué de deux protons et d'aucun neutron, et est pour cette raison appelé « diproton ». Les diprotons sont théoriquement instables à cause des interactions spin-spin et du principe d'exclusion de Pauli qui forcerait les deux protons à avoir des spins anti-alignés, ce qui donnerait au diproton une énergie de liaison négative[5].
Il est possible qu'il y ait eu des observations d'2He instable. En 2000, des physiciens ont observé pour la première fois un nouveau type de désintégration radioactive dans laquelle un noyau émet deux protons à la fois, et donc peut être un noyau d'2He[6] - [7]. L'équipe dirigée par Alfredo Galindo-Uribarri de l'Oak Ridge National Laboratory ont choisi un isotope du néon avec une structure énergétique qui l'empêche d'émettre un seul proton à la fois, signifiant que seuls deux protons peuvent être éjectés, simultanément. L'équipe a alors mis une cible enrichie en protons sous un faisceau d'ion fluor pour produire du 18Ne, qui se désintègre ensuite en oxygène et deux protons. Tout proton éjecté de la cible a été identifié par sa caractéristique énergétique. Il existe deux façons pour que l'émission des deux protons ait lieu : le noyau de néon peut éjecter un 'diproton' qui se désintègre ensuite en se séparant en deux protons, mais aussi les deux protons peuvent être émis séparément mais de façon simultanée, phénomène appelé « désintégration démocratique » (« democratic decay »). Si l'expérience a bien montré que l'émission de deux protons simultanée était possible, les paramètres n'étaient pas assez fins pour déterminer selon quel mode a eu lieu cette émission.
La meilleure preuve de l'existence d'2He a été trouvée en 2008 à l'Istituto Nazionale di Fisica Nucleare, en Italie. Dans cette expérience, les chercheurs ont bombardé une feuille de béryllium avec un faisceau de 20Ne. Dans la collision, certains atomes de néon se transformèrent en 18Ne. Les noyaux sont ensuite entrés en collision avec une feuille de plomb. Cette seconde collision a eu pour effet d'exciter les noyaux de 18Ne dans un état très instable. Comme lors de l'expérience d'Oak Ridge, les noyaux de 18Ne se sont désintégrés en noyaux d'16O, et deux protons émis depuis la même direction. La nouvelle expérience a montré que les deux protons ont été éjectés ensemble avant de se désintégrer en deux protons séparés un milliardième de seconde plus tard.
De même RIKEN au Japon et au JINR de Dubna en Russie, il a été découvert durant la production d'5He par collision entre un faisceau de noyaux d'6He et une cible d'hydrogène cryogénique, que les noyaux d'6He pouvaient donner leurs quatre neutrons à l'hydrogène ; ceci laisse donc deux protons qui peuvent être éjectés simultanément de la cible, sous le forme d'2He qui se désintègre rapidement en deux protons. Une réaction similaire a aussi été observée lors de la collision entre des noyaux d'8He et de l'hydrogène.
Hélium 3
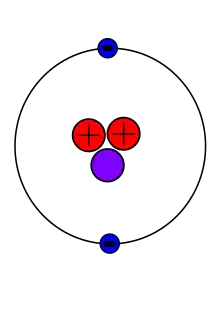
2 protons, 1 neutron, 2 électrons
L'hélium 3 (3He) n'est présent qu'à l'état de trace sur Terre, principalement présent depuis la formation de la Terre, même si une petite quantité arrive sur Terre piégée dans de la poussière interstellaire[3]. Certaines traces proviennent aussi de la désintégration β du tritium[8]. Dans les étoiles par contre, 3He est plus abondant car c'est un produit de fusion nucléaire. Certains matériaux extra-planétaires tel que la régolithe des satellites ou des astéroïdes contiennent des traces d'3He de par leur exposition aux vents solaires.
Hélium 4

2 protons, 2 neutrons, 2 électrons
L'hélium 4 (4He) est l'isotope le plus commun de l'hélium. Il est produit sur Terre par la désintégration α d'éléments radioactifs plus lourds, les particules α ainsi émises étant des atomes d'4He totalement ionisés. Il a été produit en très grandes quantités lors de la nucléosynthèse primordiale. 4He est un noyau particulièrement stable, cela étant dû au fait que ses nucléons forment une couche complète.
Hélium 5
L'hélium 5 (5He) est l'isotope de l'hélium à la durée de vie la plus courte avec une demi-vie de 7,6×10−22 seconde. Il a un noyau constitué de deux protons et de trois neutrons. Il se désintègre principalement par émission de neutron en 4He.
Hélium 6
L'hélium 6 (6He) est l'isotope instable de l'hélium avec la durée de vie la plus longue (demi-vie de 0,8 s). Il a un noyau formellement constitué de deux protons et de quatre neutrons, mais il est en fait constitué d'un noyau d'hélium 4 entouré par un « halo » de deux neutrons. Il se désintègre par désintégration β− en formant un atome de lithium 6. Dans de très rares cas, il peut subir une fission nucléaire, accompagné d'un rayonnement β pour former de l'hélium 4 et du deutérium. Il peut être formé dans des rares cas de fission ternaire (7 % des cas de fission ternaire, qui représente 0,2 à 0,4 % des fissions nucléaires).
Hélium 7
L'hélium 7 (7He) est un isotope à durée de vie très courte (demi-vie de 2,9×10−21 s). Il a un noyau constitué de deux protons et de cinq neutrons et se désintègre par émission de neutron en hélium 6. L'hélium 7 est un « hyperfragment » créé par certaines réactions nucléaires[9].
Hélium 8
L'hélium 8 (8He) est l'isotope lourd de l'hélium le plus étudié. Comme l'hélium 6, son noyau est constitué d'un noyau d'hélium 4 entouré par un « halo », mais à quatre neutrons. Sa durée de vie est relativement longue (demi-vie de 0,1 s). Il se désintègre majoritairement par désintégration β− pour former 8Li, plus rarement par désintégration β− et émission de neutron pour former 7Li et dans certains cas beaucoup plus rares, par désintégration β− et fission pour former 5He et 3H. Comme l'hélium 7, c'est un « hyperfragment » créé par certaines réactions nucléaires[9].
Table des isotopes
| Symbole de l'isotope |
Z (p) | N (n) | Masse isotopique (u) | Demi-vie | Mode(s) de désintégration[10] |
Isotope(s)-fils[n 1] | Spin nucléaire
et parité |
Composition isotopique représentative (fraction molaire) |
Gamme de variations naturelles (fraction molaire) |
|---|---|---|---|---|---|---|---|---|---|
| 2He | 2 | 0 | |||||||
| 3He[n 2] | 2 | 1 | 3,0160293191(26) | Stable[n 3] | 1/2+ | 1,34(3)×10−6 | 4,6×10−10-4,1×10−5 | ||
| 4He[n 2] | 2 | 2 | 4,00260325415(6) | Stable | 0+ | 0,99999866(3) | 0,999959-1 | ||
| 5He | 2 | 3 | 5,01222(5) | 700(30)×10−24 s [0,60(2) MeV] |
n | 4He | 3/2- | ||
| 6He[n 4] | 2 | 4 | 6,0188891(8) | 806,7(15) ms | β− (99,99 %) | 6Li | 0+ | ||
| β−,d[n 5] (2,8×10−4 %) | 4He | ||||||||
| 7He | 2 | 5 | 7,028021(18) | 2,9(5)×10−21 s [159(28) keV] |
n | 6He | (3/2)- | ||
| 8He[n 6] | 2 | 6 | 8,033922(7) | 119,0(15) ms | β− (83,1 %) | 8Li | 0+ | ||
| β−,n (16,0 %) | 7Li | ||||||||
| β−,t[n 7] (0,09 %) | 5He | ||||||||
| 9He | 2 | 7 | 9,04395(3) | 7(4)×10−21 s [100(60) keV] |
n | 8He | 1/2(-#) | ||
| 10He | 2 | 8 | 10,05240(8) | 2,7(18)×10−21 s [0.17(11) MeV] |
2n | 8He | 0+ | ||
- Isotopes stables en gras.
- Produit durant la nucléosynthèse primordiale.
- 3He et 1H sont les seuls isotopes stables avec plus de protons que de neutrons.
- Possède 2 neutrons en halo.
- Émission d'un deutéron
- Possède 4 neutrons en halo.
- Émission d'un triton
Remarques
- La composition isotopique est celle de l'air.
- La précision de l'abondance isotopique et de la masse atomique est limitée par des variations. Les échelles de variations données sont normalement valables pour tout matériel terrestre normal.
- Il existe des échantillons géologiques exceptionnels dont la composition isotopique est en dehors de l'échelle donnée. L'incertitude sur la masse atomique de tels spécimens peut excéder les valeurs données.
- Les valeurs marquées # ne sont pas purement dérivées des données expérimentales, mais aussi au moins en partie à partir des tendances systématiques. Les spins avec des arguments d'affectation faibles sont entre parenthèses.
- Les incertitudes sont données de façon concise entre parenthèses après la décimale correspondante. Les valeurs d'incertitude dénotent un écart-type, à l'exception de la composition isotopique et de la masse atomique standard de l'IUPAC qui utilisent des incertitudes élargies.
Références
- (en) J. Emsley, Nature's Building Blocks : An A-Z Guide to the Elements, Oxford, Oxford University Press, , 538 p., poche (ISBN 978-0-19-850340-8, lire en ligne), p. 178.
- (en) G.N. Zastenker et al., « Isotopic Composition and Abundance of Interstellar Neutral Helium Based on Direct Measurements », Astrophysics, vol. 45, no 2, , p. 131–142 (DOI 10.1023/A:1016057812964, Bibcode 2002Ap.....45..131Z, lire en ligne).
- (en) « Helium Fundamentals ».
- (en) The Encyclopedia of the Chemical Elements, p. 264.
- Nuclear Physics in a Nutshell, C.A. Bertulani, Princeton University Press, Princeton, NJ, 2007, Chapter 1, (ISBN 978-0-691-12505-3).
- Physicists discover new kind of radioactivity, in physicsworld.com Oct 24, 2000.
- Decay of a Resonance in 18Ne by the Simultaneous Emission of Two Protons, Physical Review Online Archive, by del Campo, Galindo-Uribarri et al.
- (en) K. L. Barbalace, « Periodic Table of Elements: Li - Lithium », EnvironmentalChemistry.com (consulté le ).
- (en) The Encyclopedia of the Chemical Elements, p. 260.
- (en)Universal Nuclide Chart.
- Masse des isotopes depuis :
- (en) G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon, « The NUBASE evaluation of nuclear and decay properties », Nuclear Physics A, vol. 729, , p. 3–128 (DOI 10.1016/j.nuclphysa.2003.11.001, Bibcode 2003NuPhA.729....3A, lire en ligne [archive du ])
- Compositions isotopiques et masses atomiques standards :
- (en) J. R. de Laeter, J. K. Böhlke, P. De Bièvre, H. Hidaka, H. S. Peiser, K. J. R. Rosman and P. D. P. Taylor, « Atomic weights of the elements. Review 2000 (IUPAC Technical Report) », Pure and Applied Chemistry, vol. 75, no 6, , p. 683–800 (DOI 10.1351/pac200375060683, lire en ligne)
- (en) M. E. Wieser, « Atomic weights of the elements 2005 (IUPAC Technical Report) », Pure and Applied Chemistry, vol. 78, no 11, , p. 2051–2066 (DOI 10.1351/pac200678112051, résumé, lire en ligne)
- Demi-vie, spin et données sur les isomères sélectionnés depuis les sources suivantes :
- (en) G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon, « The NUBASE evaluation of nuclear and decay properties », Nuclear Physics A, vol. 729, , p. 3–128 (DOI 10.1016/j.nuclphysa.2003.11.001, Bibcode 2003NuPhA.729....3A, lire en ligne [archive du ])
- (en) National Nuclear Data Center, « NuDat 2.1 database », Brookhaven National Laboratory (consulté en )
- (en) N. E. Holden et D. R. Lide (dir.), CRC Handbook of Chemistry and Physics, CRC Press, , 85e éd., 2712 p. (ISBN 978-0-8493-0485-9, lire en ligne), « Table of the Isotopes », Section 11
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Isotopes of helium » (voir la liste des auteurs).
Voir aussi
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |