Forêt de varech
Une forêt de varech[1] (kelp forest[2] en anglais) est une zone sous-marine densément peuplée de varech, des macroalgues brunes poussant dans des eaux de climats tempérés et arctiques, sur des substrats solides, tels que des substrats rocheux. Le varech, notamment par sa taille imposante, procure un habitat unique à bon nombre d'espèces marines. Certaines de ces zones figurent parmi les écosystèmes les plus productifs et diversifiés de la planète[3] - [4] - [5].




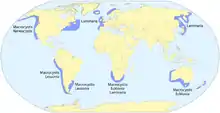
On trouve des forêts de varech près des côtes des océans tempérés et polaires[3]. Toutefois, en 2007, on en a découvert dans les eaux tropicales de l'Équateur[6].
Au cours du dernier siècle, ces habitats uniques ont fait l'objet de recherches approfondies, particulièrement en écologie trophique, et continuent de générer des idées pertinentes à la compréhension générale des écosystèmes. Par exemple, les forêts de varech peuvent influencer les courants marins côtiers[7] et rendent de nombreux services écologiques[8].
Cependant, l'activité anthropique a souvent contribué à la dégradation des forêts sous-marines. Parmi les principales menaces se trouve la surpêche des écosystèmes côtiers, qui peut supprimer la régulation naturelle des populations d'herbivores et entraîner en un broutement intensif des varech et autres algues[9]. Il peut rapidement en résulter des zones presque totalement dénudées de végétation[4] (voir p. ex. les landes à oursins (en)).
Architecture et composition
L'architecture d'une forêt marine dépend de la ou les espèces qui la dominent et influence les espèces associées qui définissent la communauté. Traditionnellement, cet écosystème comprend trois guildes occupées par du varech et deux autres occupées par d'autres algues[4]:

- le varech de la canopée flottante, qui comprend les plus grandes espèces d'algues (p. ex. Macrocystis pouvant atteindre plus de 45 m de hauteur, Alaria). Caractérisées par un stipe flexible et une fronde pourvue de pneumatocystes, elles atteignent fréquemment la surface[10] ;
- le varech stipité, qui comprend des espèces dressées s'élevant à quelques mètres au-dessus du fond. Caractérisées par un stipe rigide, elles sont représentées par plusieurs espèces qui peuvent former de denses bosquets (p. ex. Laminaria, Ecklonia, Eisenia…) ;
- le varech prostré, qui comprend les espèces dotées d'une fronde qui recouvre le substrat et qui demeurent près du fond (p. ex. Laminaria et Saccharina) ;
- l'assemblage benthique, formé d'autres espèces d'algues (filamenteuses, « foliées », corallines articulées) et d'organismes sessiles ;
- les algues encroûtantes (corallines).
Les espèces composant les forêts de varech varient et peuvent cohabiter. Les algues du genre Laminaria dominent les forêts sous-marines des deux côtés de l'océan Atlantique, de même que celles des côtes chinoise et japonaise. Macrocystis pyrifera, aussi connu sous le nom de varech géant (giant kelp), est une espèce qui forme ce type d'écosystème dans plusieurs régions du monde, dont le nord-est du Pacifique, le sud de l'Amérique du Sud, l'Afrique du Sud, l'Australie, la Nouvelle-Zélande et plusieurs îles de l'Océan Austral. Des espèces du genre Ecklonia dominent aussi quelques forêts en Australie, en Nouvelle-Zélande, en Afrique du Sud et autour de quelques îles subantarctiques[4].
La stratification verticale forme un système de micro-environnements similaires à ceux retrouvés en forêt terrestre, avec une canopée ensoleillée, un milieu partiellement abrité, et un plancher ombragé[4]. Chaque guilde possède ses organismes associés dont l'assemblage peut varier en fonction de la morphologie du varech[11] - [12] - [13]. Par exemple, dans les forêts californiennes de Macrocystis pyrifera, le nudibranche Melibe leonina et l'amphipode Caprella californica sont étroitement associés à la canopée en surface; les poissons Brachyistius frenatus et Sebastes spp. se retrouvent au sein de l'étage stipité; des ophiures et des gastéropodes Tegula spp. sont associés aux crampons des algues tandis que divers herbivores tels des oursins et des ormeaux vivent sous la canopée prostrée; plusieurs étoiles de mer, hydroïdes et poissons benthiques vivent au sein de l'assemblage benthique; des coraux solitaires, des gastéropodes variés et des échinodermes vivent sur les corallines encroûtantes[11]. De plus, des poissons pélagiques et des mammifères marins sont vaguement associés aux forêts de varech, se tenant la plupart du temps aux bords de l'écosystème lorsqu'ils viennent se nourrir d'organismes résidents.
Croissance
Ces algues géantes peuvent vivre dans la zone infra-littorale jusqu’à 30 mètres de profondeur et peuvent atteindre une taille record de 60 mètres. Elles poussent d’environ 20 centimètres par jour[14]. Elles peuvent donc avoir une taille comparable à celle des arbres terrestres et dominent la côte californienne [15].
Le varech a besoin de substrats solides, par exemple un fond rocheux, afin de se cramponner et résister au fort courant. Il est primordial qu’il y ait assez de lumière pour que même les jeunes plants puissent y avoir accès afin d’assurer leur croissance et le renouvellement des individus. La croissance sera limitée, entre autres, par l’apport de nutriments, particulièrement l’azote [16]. Une eau chaude tropicale n’est pas propice à la dispersion du varech car elle a une quantité insuffisante de minéraux. Cependant, dans certains endroits où l’eau est généralement plus chaude, une remontée d’eau profonde et froide riche en nutriments vient compenser cette carence en azote[14].
Production primaire nette
Dans un habitat dominé par le varech, les lames érodées forment de 30 à 40 % de la production primaire nette et plusieurs facteurs peuvent influencer cette production[15]. Premièrement, le mouvement de l’eau doit être suffisamment puissant afin d’entraîner avec lui les débris et amener les nutriments essentiels à ces algues géantes. Par la suite, la lumière est aussi très importante afin de permettre la photosynthèse. Fait intéressant, les algues peuvent moduler leur quantité totale de pigments et la proportion de ceux-ci dans la lame selon les différents pigments nécessaires à la photosynthèse. Ces ajustements permettent qu’une photosynthèse faite à 11 mètres de profondeur n’ait pas un rendement si différent de celle à 5 mètres[15]. Des phénomènes météorologiques tels qu'El Niño peuvent également influencer annuellement l’état des forêts de varech en modifiant la dynamique des courants marins. Le manque de nutriments et la destruction par des forces mécaniques, comme les vagues engendrées par des ouragans, vont avoir une incidence sur la croissance des algues, car dans une tempête, une algue détachée de son substrat avec ses 60 mètres de long, peut en arracher d’autres sur son passage et ainsi détruire une grande partie de la forêt.
Écologie
« Le nombre de créatures vivantes de tout ordre dont l'existence dépend intimement des forêts d'algues est merveilleux. Je ne peux que comparer ces grandes forêts aquatiques avec celles terrestres des régions intertropicales. Pourtant, si dans un pays une forêt était détruite, je ne crois pas qu'autant d'espèces animales périraient qu'ici, à cause de la destruction des algues[17]. »
— Charles Darwin, Le Voyage du Beagle
Ces forêts marines sont réputées être l'un des habitats et écosystèmes les plus productifs et dynamiques de la planète[3] car elles offrent une multitude d’habitats, en raison de leur grande variance tridimensionnelle[18]. Elles constituent un habitat particulièrement apprécié de la loutre de mer.
Les grandes algues brunes sont dites espèce fondatrice et espèce clé de voûte. Elles forment des oasis sous-marines. Dans l'estran, elles protègent de la lumière et de la déshydratation. Elles abritent les invertébrés fixés au substrat, et une communauté microbienne dont la nature et l'importance est comparable au microbiote intestinal et cutané des humains. Leur activité de photosynthèse est très importante, car on estime leur surface équivalente à la forêt amazonienne, pour des productivités de recyclage des équivalents carbone et d'émission d'oxygène deux fois supérieures. -[17].
L'état de santé d'une forêt de varech dépend de l'équilibre du réseau trophique complexe qu'elle abrite.
Pression d'herbivorie
L’herbivore le plus redoutable des forêts de varech est l’oursin. Lorsque leur nombre est faible, les oursins vivent dans des crevasses, cachés des prédateurs, et se nourrissent des débris produits par le varech. Cependant, lorsque leur nombre augmente, ils sortent des crevasses et s’agglomèrent autour des stipes. En peu de temps, ils les mangent et le varech sont détachés du substrat par leur base. Aussi, si les algues sont petites, les oursins vont manger l’algue au complet. La destruction est alors entamée. À Point Loma, en Californie, la forêt sous-marine est passée de 15,5 km2 à 0,22 km2 de 1911 à 1960 à cause de la pression d'herbivorie des oursins[15].
Ces invasions d'oursins peuvent être dues à la disparition de leurs prédateurs (loutre de mer en Californie) ou à la suppression d'autres sources alimentaires, comme les algues dérivantes en Australie[19].
Origine anthropique de la détérioration des forêts de varech
La surabondance des oursins a dans certains cas une origine anthropique. En effet, la surpêche (et d'autres facteurs tels que le changement climatique) a mené à une diminution considérable des stocks de poissons mais aussi d'espèces qui se nourrissent de poissons, comme des oiseaux marins et des mammifères marins (notamment des pinnipèdes tels que les phoques). Tous ces animaux font partie des proies principales des orques (Orcinus orca), qui, en réponse à la diminution du nombre de leurs proies habituelles, ont trouvé une autre proie : la loutre (Enhydra lutris). Les populations de loutres ont ainsi fortement diminué à leur tour[20]. Ceci a causé la prolifération des oursins dont se nourrissent les loutres, et cause donc la dégradation de cet habitat riche et important pour plusieurs espèces qu’est le varech.
Interactions durables entre loutres et forêts de varech
Ces algues permettent aux loutres de ne pas dériver quand elles s'endorment ou se reposent. Elles y jouent avec leurs petits, et s'enveloppent volontiers dans les feuilles flottantes de surface, ce qui semble les protéger des tempêtes et des courants. Elles trouvent dans cet écosystème une abondante nourriture. La loutre de mer n'est cependant pas strictement inféodée aux forêts de varech. Des groupes de loutres vivent dans des zones dépourvues de varech.
Des biologistes marins ont montré que la loutre de mer avait un impact très favorable sur l’extension de certaines forêts de varech ; les loutres mangent en effet énormément d’oursins, qui sont des brouteurs du varech. Là où les loutres sont encore présentes ou là où elles reviennent, le varech se porte mieux et ses forêts se développent, permettant à toutes sortes d’animaux de s’y développer. Là où les loutres sont absentes, les forêts de varech sont dégradées et plus restreintes[21].
Hypothèse de la forêt de varech
En 2007, l'archéologue Jon M. Erlandson (en) émet l'hypothèse de la forêt de varech, ou autoroute du kept : le premier peuplement de l'Amérique serait arrivé par la côte ouest il y a 17 000 ans en suivant les forêts de varech à la base de chaînes trophiques complexes (abondance de coquillages, de mammifères marins, d'oiseaux de mer), apportant aux colons une alimentation suffisante[22] - [17].
Voir aussi
Articles connexes
Bibliographie
Liens externes
Notes et références
- « Glossaire : Varech », sur www.greenfacts.org (consulté le )
- « Glossary: Kelp », sur www.greenfacts.org (consulté le )
- K.H. Mann (1973) Seaweeds: their productivity and strategy for growth. Science 182: 975-981.
- P.K. Dayton (1985) Ecology of kelp communities. Annual Review of Ecology and Systematics 16: 215-245.
- (en) Albert Pessarrodona, Jorge Assis, Karen Filbee-Dexter et Michael T. Burrows, « Global seaweed productivity », Science Advances, vol. 8, no 37, , eabn2465 (ISSN 2375-2548, PMID 36103524, PMCID PMC9473579, DOI 10.1126/sciadv.abn2465, lire en ligne, consulté le )
- M.H. Graham, B. Phi. Kinlan, L.D. Druehl, L.E. Garske, and S. Banks (2007) Deep-water kelp refugia as potential hotspots of tropical marine diversity and productivity. Proceedings of the National Academy of Sciences 104 (42): 16576-16580.
- Jackson, G.A. and C.D. Winant (1983) Effect of a kelp forest on coastal currents. Continental Shelf Report 2: 75-80.
- Steneck, R.S., M.H. Graham, B.J. Bourque, D. Corbett, J.M. Erlandson, J.A. Estes and M.J. Tegner (2002) Kelp forest ecosystems: biodiversity, stability, resilience and future. Environmental Conservation 29(4): 436-459.
- Sala, E., C.F. Bourdouresque and M. Harmelin-Vivien (1998). Fishing, trophic cascades, and the structure of algal assemblages: evaluation of an old but untested paradigm. Oikos 82: 425-439.
- Cette strate supérieure est occupée par des macroalgues brunes principalement de l'ordre des laminariales. En mode très abrité, des macroalgues benthiques peuvent se détacher du substrat (après décrochage ou fragmentation sous l'effet d'un choc) et former de grandes communautés flottantes qui continuent à se développer (Ulves, sargasses), constituant des champs d'algues qui évoquent des forêts flottantes.
- Foster, M.S. and D.R. Schiel. 1985. The ecology of giant kelp forests in California: a community profile. US Fish and Wildlife Service Report 85: 1-152.
- Graham, M.H. 2004. Effects of local deforestation on the diversity and structure of Southern California giant kelp forest food webs. Ecosystems 7: 341-357.
- Fowler-Walker, M.J., B. M. Gillanders, S.D. Connell and A.D. Irving. 2005. Patterns of association between canopy-morphology and understory assemblages across temperate Australia. Estuarine, Coastal and Shelf Science 63: 133-141.
- J. W. Nybakken et M. D. Bertness, 2005, Marine Biology: an ecological approach, sixth edition, San Francisco, Benjamin Cummings, 579 p.
- K. H. Mann, 2000, Ecology of Coastal Waters with implications for management, Second edition, Nova Scotia, Blackwell Science, 406 p.
- R. C. Zimmerman et J. N. Kremer, 1984, Episodic nutrient supply to a kelp forest ecosystem in Southern California, Journal of Marine Research, 42,591-604
- Philippe Potin, « Les forêts d'algues, une richesse insoupçonnée », sur www.larecherche.fr (consulté le )
- M. H. Graham, 2004, Effects of local deforestation on the diversity and structure of southern California giant kelp forest food webs, Ecosystems, Springer, 7, 342-357
- N. Kriegisch, S.E. Reeves, E.B. Flukes, C.R. S.D. Ling, « Drift‑kelp suppresses foraging movement of overgrazing sea urchins », Oekologia, (DOI 10.1007/s00442-019-04445-6, lire en ligne).
- J. A. Estes, M. T. Tinker, T. M. Williams et D. F. Doak, 1998, Killer Whale Predation on Sea Otters Linking Oceanic and Nearshore Ecosystems, Sciences, New Series, 5388, 473-476
- « Sea otters and kelp forests in Alaska: generality and variation in a community ecological paradigm », par J.A. Estes et D. Duggins, publié dans Ecological Monographs (65: 75-100), 1995.
- (en) Jon M. Erlandson et al., « The Kelp Highway Hypothesis: Marine Ecology, the Coastal Migration Theory, and the Peopling of the Americas », Journal of Island & Coastal Archaeology, vol. 2, no 2, , p. 161-174.