Entérobactine
L'entérobactine, ou entérochéline, est le plus puissant sidérophore connu, produit notamment par des bactéries à Gram négatif telles qu’Escherichia coli et Salmonella typhimurium[2] : elle chélate les cations Fe3+ avec une affinité valant K = 1052 M-1[3], c'est-à-dire bien supérieure à celle de chélateurs synthétiques tels que l'EDTA (Kf,Fe3+ ~ 1025 M−1)[4]. Cette affinité remarquablement élevée permet aux microorganismes qui sont capables d'utiliser ce composé de concentrer le fer ferrique même lorsqu'il n'est présent qu'à très faible concentration molaire dans le milieu extracellulaire. Des bactéries sont ainsi capables d'absorber le fer dissous au sein d'autres organismes, chez lesquels la concentration en fer demeure toujours très faible en raison de la toxicité du fer libre.
| Entérobactine | |
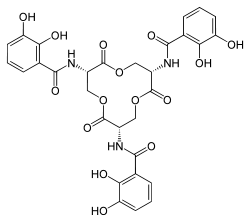 Structure de l'entérobactine |
|
| Identification | |
|---|---|
| Nom UICPA | N,N’,N’’-[(3S,7S,11S)-2,6,10-trioxo-1,5,9-trioxacyclododécane-3,7,11-triyl]tris(2,3-dihydroxybenzamide) |
| Synonymes |
entérochéline |
| No CAS | |
| PubChem | 34231 |
| ChEBI | 28855 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C30H27N3O15 [Isomères] |
| Masse molaire[1] | 669,546 5 ± 0,031 g/mol C 53,82 %, H 4,06 %, N 6,28 %, O 35,84 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
La biosynthèse de l'entérobactine commence par la conversion d'un précurseur, l'acide chorismique, en acide 2,3-dihydroxybenzoïque (DHB) par une série d'enzymes appelées EntA, EntB et EntC. Une liaison amide est alors formée entre le DHB et une molécule de L-sérine par les enzymes EntD, EntE, EntF et EntB. Trois molécules de DHB-Ser formées subissent alors une cyclisation intermoléculaire conduisant à l'entérobactine[5]. Bien que de nombreux stéréoisomères soient possibles en raison de la chiralité des résidus de sérine, seul l'isomère Δ-cis est métaboliquement actif[4].
Lorsque les cellules bactériennes viennent à manquer d'ions ferriques, elles sécrètent de l'entérobactine dans le milieu extracellulaire afin d'y chélater les cation Fe3+. Chez E. coli, la protéine FepA de la membrane externe permet au complexe ferrientérobactine (FeEnt) d'entrer dans le périplasme. Les protéines FepB, FepC, FepD et FepG interviennent ensuite pour transporter le complexe FeEnt à travers la membrane interne de la bactérie (membrane plasmique) à l'aide d'un transporteur ABC[6].
En raison de la très forte affinité de l'entérobactine pour les cations Fe3+, il est nécessaire de cliver le complexe FeEnt afin d'en libérer l'ion ferrique. Cela est réalisé par une enzyme, la ferrientérobactine estérase, qui libère trois unités 2,3-dihyroxybenzoyl-L-sérine et un ion ferreux Fe2+ : la réduction du fer ferrique Fe3+ en fer ferreux Fe2+ est concomitante au clivage mais aucune réductase bactérienne du complexe ferrientérobactine n'a été identifié et le mécanisme de cette réaction demeure obscur[5]. Le potentiel d'oxydoréduction du complexe Fe3+/Fe2+-entérobactine dépend du pH et varie entre −0,57 V par rapport à l'ESH à pH = 6 et −0,99 V à pH > 10,4 en passant par −0,79 V à pH = 7,4[7].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Emily A. Dertz, Jide Xu, Alain Stintzi et Kenneth N. Raymond, « Bacillibactin-Mediated Iron Transport in Bacillus subtilis », Journal of the American Chemical Society, vol. 128, no 1, , p. 22-23 (lire en ligne) DOI 10.1021/ja055898c
- (en) Carl J. Carrano et Kenneth N. Raymond, « Ferric ion sequestering agents. 2. Kinetics and mechanism of iron removal from transferrin by enterobactin and synthetic tricatechols », Journal of the American Chemical Society, vol. 101, no 18, , p. 5401-5404 (lire en ligne) DOI 10.1021/ja00512a047
- (en) Christopher T. Walsh, Jun Liu, Frank Rusnak et Masahiro Sakaitani, « Molecular studies on enzymes in chorismate metabolism and the enterobactin biosynthetic pathway », Chemical Reviews, vol. 90, no 7, , p. 1105-1129 (lire en ligne) DOI 10.1021/cr00105a003
- (en) Thomas R. Ward, Andreas Lutz, Serge P. Parel, Jürgen Ensling, Philipp Gütlich, Péter Buglyó, et Chris Orvig, « An Iron-Based Molecular Redox Switch as a Model for Iron Release from Enterobactin via the Salicylate Binding Mode », Inorganic Chemistry, vol. 38, no 22, , p. 5007-5017 (lire en ligne) DOI 10.1021/ic990225e
- (en) Kenneth N. Raymond, Emily A. Dertz et Sanggoo S. Kim, « Enterobactin: An archetype for microbial iron transport », Proceedings of the National Academy of Sciences of the United States of America, vol. 100, no 7, , p. 3584-3588 (lire en ligne) DOI 10.1073/pnas.0630018100
- (en) Chi Woo Lee, David J. Ecker et Kenneth N. Raymond, « Coordination chemistry of microbial iron transport compounds. 34. The pH-dependent reduction of ferric enterobactin probed by electrochemical methods and its implications for microbial iron transport », Journal of the American Chemical Society, vol. 107, no 24, , p. 6920–6923 (lire en ligne) DOI 10.1021/ja00310a030