Dichlorodifluorométhane
Le dichlorodifluorométhane CCl2F2, aussi vendu sous l'appellation Freon-12 ou R12 selon la liste des gaz fluorés et frigorigènes, est un chlorofluorocarbure (CFC) utilisé comme propulseur dans les aérosols jusqu'à ce que sa fabrication ait été interdite en 1996 dans les pays développés et en 2010 dans les pays en développement[9]. Le potentiel de déplétion ozonique de CFC-12 est 0,82, ce qui est relativement élevé. Cependant, en 2005, on le trouve encore avec le trichlorofluorométhane en aérosols.
| Dichlorodifluorométhane | ||
| ||
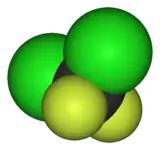 | ||
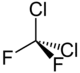
| Représentation du dichlorodifluorométhane. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Dichlorodifluorométhane | |
| Synonymes |
R 12 |
|
| No CAS | ||
| No ECHA | 100.000.813 | |
| No CE | 200-893-9 | |
| No RTECS | PA8200000 | |
| PubChem | 6391 | |
| No E | E940 | |
| SMILES | ||
| InChI | ||
| Apparence | gaz comprimé liquéfié incolore, d'odeur caractéristique[1]. | |
| Propriétés chimiques | ||
| Formule | CCl2F2 [Isomères] |
|
| Masse molaire[2] | 120,914 ± 0,005 g/mol C 9,93 %, Cl 58,64 %, F 31,42 %, |
|
| Moment dipolaire | 0,51 ± 0,05 D[3] | |
| Propriétés physiques | ||
| T° fusion | −158 °C[1] | |
| T° ébullition | −30 °C[1] | |
| Solubilité | dans l'eau à 20 °C : 0,3 g l−1[1] | |
| Paramètre de solubilité δ | 11,3 MPa1/2 (25 °C)[4] | |
| Masse volumique | 1,5 g cm−3[1] | |
| Pression de vapeur saturante | à 20 °C : 568 kPa[1] | |
| Point critique | 41,4 bar, 111,85 °C[5] | |
| Thermochimie | ||
| ΔvapH° | 166,95 kJ/kg (1,013 bar au point d'ébullition) | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 12,05 ± 0,24 eV (gaz)[6] | |
| Précautions | ||
| SIMDUT[7] | ||
 A, |
||
| Directive 67/548/EEC[8] | ||
 N |
||
| Transport[8] | ||
| Écotoxicologie | ||
| LogP | 2,16[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Applications industrielles
Principales applications du dichlorodifluorométhane avant son interdiction d'emploi :
- ancien fluide frigorigène pour :
- les installations frigorifiques (industrielles, commerciales et domestiques),
- les systèmes de climatisation,
- les climatisations de véhicules automobiles ;
- ancien propulseur pour aérosols en droguerie, cosmétologie et thérapeutique (souvent en association avec le trichlorofluorométhane) ;
- agent gonflant pour les mousses de polymères.
Il est désormais remplacé par le R134a (Protocole de Montréal : accord international pour la protection de la couche d'ozone stratosphérique).
Le dichlorodifluorométhane est toujours inscrit dans la liste officielle des additifs alimentaires du codex Alimentarius, sous l'appellation « E940 »[10].
 Évolution de la concentration atmosphérique en CFC-12.
Évolution de la concentration atmosphérique en CFC-12.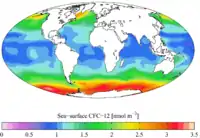 Concentration en CFC-12 à la surface océanique dans les années 1990.
Concentration en CFC-12 à la surface océanique dans les années 1990. Concentration océanique en CFC-12 dans les années 1990.
Concentration océanique en CFC-12 dans les années 1990.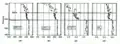 Répartition verticale de différents composants.
Répartition verticale de différents composants.
Propriétés
Phase liquide
- Équivalent gaz/liquide (1,013 bar et 15 °C) : 292 vol/vol.
Phase gazeuse
- Masse volumique du gaz (1,013 bar au point d'ébullition) : 6,25 kg m−3.
- Masse volumique de la phase gazeuse (1,013 bar et 15 °C) : 5,11 kg m−3.
- Facteur de compressibilité (Z) (1,013 bar et 15 °C) : 0,995.
- Densité (air = 1) (1,013 bar et 21 °C) : 4,2.
- Volume spécifique (1,013 bar et 21 °C) : 0,195 m3/kg.
- Chaleur spécifique à pression constante (Cp) (1,013 bar et 30 °C) : 0,074 kJ mol−1 K−1.
- Chaleur spécifique à volume constant (Cv) (1,013 bar et 30 °C) : 0,065 kJ mol−1 K−1.
- Rapport des chaleurs spécifiques (γ : Cp/Cv) (1,013 bar et 30 °C) : 1,14.
- Viscosité (1,013 bar et 0 °C) : 0,011 68 cP.
- Conductivité thermique (1,013 bar et 0 °C) : 9,46 mW m−1 K−1.
Notes et références
- DICHLORODIFLUOROMETHANE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50.
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294.
- (en) « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- « Dichlorodifluorométhane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009.
- Entrée « Dichlorodifluoromethane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 24 avril 2009 (JavaScript nécessaire).
- Scientific assessment of ozone depletion: 2018., Geneva, Switzerland, World Meteorological Organization, , Global Ozone Research and Monitoring Project–Report No. 58 éd. (ISBN 978-1-7329317-1-8, lire en ligne), « 1:Update on Ozone-Depleting Substances (ODSs) and Other Gases of Interest to the Montreal Protocol », p. 1.10
- « Noms de catégorie et système international de numérotation des additifs alimentaires », sur codexalimentarius.net, (consulté le ).
