Complexe 3-méthyl-2-oxobutanoate déshydrogénase
Le complexe 3-méthyl-2-oxobutanoate déshydrogénase est l'association de trois enzymes — une décarboxylase, une acyltransférase et une oxydo-réductase — agissant séquentiellement dans cet ordre :
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | TPP |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Ce complexe enzymatique intervient dans la dégradation des acides aminés à chaîne latérale ramifiée, tels que la valine, l'isoleucine et la leucine. Il est structurellement apparenté au complexe pyruvate déshydrogénase et au complexe alpha-cétoglutarate déshydrogénase.
La réaction globale catalysée par le complexe 3-méthyl-2-oxobutanoate déshydrogénase est la suivante (en considérant les espèces ionisées) :
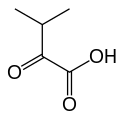
+ CoA-SH + NAD+ → NADH + H+ + CO2 + 
α-Cétovaline Isobutyryl-CoA
Le mécanisme de cette réaction, qui fait intervenir successivement les enzymes E1, E2 et E3, chacune avec ses cofacteurs, est assez complexe, et peut être résumé par le schéma simplifié ci-dessous :
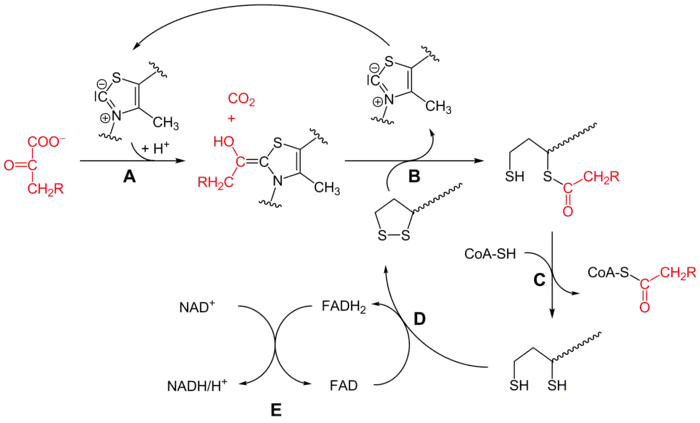 Mécanisme réactionnel du complexe 3-méthyl-2-oxobutanoate déshydrogénase (CH2R = CH(CH3)2 sur ce schéma) :
Mécanisme réactionnel du complexe 3-méthyl-2-oxobutanoate déshydrogénase (CH2R = CH(CH3)2 sur ce schéma) :
- la 3-méthyl-2-oxobutanoate déshydrogénase (E1) catalyse les étapes A et B avec la thiamine pyrophosphate (TPP),
- la dihydrolipoyl transacylase (E2) catalyse l'étape C avec le lipoamide et la coenzyme A (CoA-SH),
- la dihydrolipoyl déshydrogénase (E3) catalyse les étapes D et E avec le FAD et le NAD+.