3-Méthyl-2-oxobutanoate déshydrogénase
La 3-méthyl-2-oxobutanoate déshydrogénase, ou alpha-cétoisovalérate déshydrogénase, est une oxydoréductase faisant partie du complexe 3-méthyl-2-oxobutanoate déshydrogénase dont elle est l'enzyme E1. Cette enzyme a pour fonction de fixer une molécule d'alpha-cétoisovalérate sur un lipoamide avec l'aide d'une thiamine pyrophosphate (TPP) et libération de CO2. Elle fait partie du complexe 3-méthyl-2-oxobutanoate déshydrogénase, dont elle est l'enzyme E1, complexe qui réalise la conversion de l'α-cétovaline en Isobutyryl-CoA et CO2 :
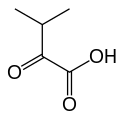 |
+ CoA-SH + NAD+ → NADH + H+ + CO2 + |  |
| α-Cétovaline | Isobutyryl-CoA |
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | TPP |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
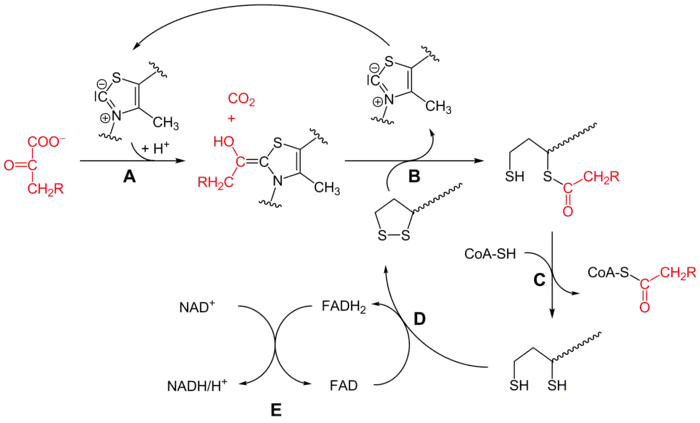
Le mécanisme de cette réaction, qui fait intervenir successivement les enzymes E1, E2 et E3, chacune avec ses cofacteurs, est assez complexe, et peut être résumé par le schéma simplifié ci-dessous :
Mécanisme réactionnel du complexe 3-méthyl-2-oxobutanoate déshydrogénase (CH2R = CH(CH3)2 sur ce schéma) :
|
Notes et références
- (en) Mischa Machius, R. Max Wynn, Jacinta L. Chuang, Jun Li, Ronald Kluger, Daria Yu, Diana R. Tomchick, Chad A. Brautigam et David T. Chuang, « A Versatile Conformational Switch Regulates Reactivity in Human Branched-Chain α-Ketoacid Dehydrogenase », Structure, vol. 14, no 2, , p. 287-298 (PMID 16472748, DOI 10.1016/j.str.2005.10.009, lire en ligne)
Articles connexes
- Pyruvate déshydrogénase, enzyme E1 du complexe pyruvate déshydrogénase
- α-Cétoglutarate déshydrogénase, enzyme E1 du complexe α-cétoglutarate déshydrogénase