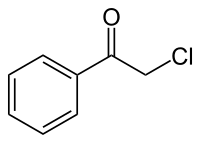
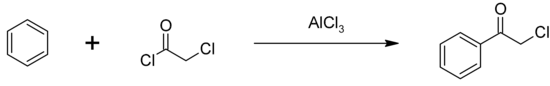Chloroacétophénone
La chloroacétophénone, chloracétophénone, ou le chlorure de phénacyle est un composé organique, dérivé de l'acétophénone. C'est un élément utile en synthèse en chimie organique, mais il est historiquement et principalement connu comme gaz lacrymogène, sous le nom de CN, utilisé dans le maintien de l'ordre par les forces de police antiémeute.
| Chloroacétophénone | |
| |
| Identification | |
|---|---|
| Nom UICPA | 2-chloro-1-phényléthanone |
| Synonymes |
2-chloroacétophénone |
| No CAS | |
| No ECHA | 100.007.757 |
| No CE | 208-531-1 |
| SMILES | |
| InChI | |
| Apparence | poudre ou cristaux blancs à jaunâtres, odeur désagréable |
| Propriétés chimiques | |
| Formule | C8H7ClO [Isomères] |
| Masse molaire[1] | 154,594 ± 0,009 g/mol C 62,15 %, H 4,56 %, Cl 22,93 %, O 10,35 %, |
| Propriétés physiques | |
| T° fusion | 59 °C[2] |
| T° ébullition | 247 °C[2] |
| Solubilité | quasiment insoluble dans l'eau[2] |
| Masse volumique | 1,32 g·cm-3[2] |
| Point d’éclair | 118 °C (coupelle fermée)[2] |
| Pression de vapeur saturante | 0,005 3 mbar à 20 °C 0,019 mbar à 30 °C 0,1 mbar à 50 °C[2] |
| Précautions | |
| Directive 67/548/EEC[2] | |
 T |
|
| Transport[2] | |
| Écotoxicologie | |
| DL50 | 139 mg·kg-1 (souris, oral)[3] 81 mg·kg-1 (souris, i.v.)[4] 60 mg·kg-1 (souris, i.p.)[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
La chloroacétophénone peut être synthétisée par une acylation de Friedel-Crafts du benzène en utilisant du chlorure de chloroacétyle, avec du trichlorure d'aluminium comme catalyseur[5] :
Agent anti-émeute
On l'a étudié durant les deux guerres mondiales, mais pas utilisé. Les forces américaines l'ont utilisé au Vietnam. Du fait de sa toxicité plus élevée, il a largement été supplanté par le 2-chlorobenzylidène malonitrile (CS). Achetée en 1937 par la Turquie de Mustafa Kemal Atatürk à l'Allemagne nazie, elle aurait aussi été utilisée lors du massacre de Dersim[6]. La police soviétique en aurait également fait usage dans le maintien de l'ordre au cours des années 1980[7].
Le CN est toujours utilisé par les forces de police ou paramilitaires, sous forme de petits aérosols pressurisés sous le nom de « Mace » ou gaz lacrymogène. Son usage a aussi chuté par le développement d'aérosols à base de gaz poivre qui fonctionne plus rapidement, et dont l'effet disparaît plus rapidement que le CN.
Le terme « Mace », à l'origine la marque de premier fabricant d'aérosol au CN, est devenu une marque utilisée comme nom aux États-Unis, comme synonyme de gaz lacrymogène.
Comme le gaz CS, ce composé irrite les muqueuses (bouche, nez, yeux, etc.). Parfois il peut avoir des effets plus généraux, comme une syncope, ou une perte temporaire de repères. Plus rarement, il peut provoquer des irritations cutanées, voire des dermatites de contact allergique.
Une haute concentration en CN peut causer des dommages aux épithéliums de la cornée voire un chémosis. Le CN serait à l'origine d'au moins cinq morts, par lésions pulmonaires ou asphyxie[8].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Phenacyl chloride » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 532-27-4 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 juillet 2010 (JavaScript nécessaire)
- National Technical Information Service. Vol. AD837-111
- Archives of Toxicology. Vol. 40, Pg. 75, 1978 PMID
- Nathan Levin and Walter H. Hartung, ω-Chloroisonitrosoacetophenone, Org. Synth., coll. « vol. 3 », , p. 191
- (tr) « Dersim’de Nazi gazı », sur yeniozgurpolitika, (consulté le )
- (ru) Alexandre Kourinianovitch, « Évenements de Minsk du 30 octobre 1988 : documents et faits supplémentaires »
 , sur Nasha Niva (Hebdomadaire biélorusse d'opposition), (consulté le )
, sur Nasha Niva (Hebdomadaire biélorusse d'opposition), (consulté le ) - (en) Blain PG, « Tear gases and irritant incapacitants. 1-chloroacetophenone, 2-chlorobenzylidene malononitrile and dibenz[b,f]-1,4-oxazepine », Toxicol Rev, vol. 22, no 2, , p. 103–10 (PMID 15071820, lire en ligne)