Bêta-borate de baryum
Le β-borate de baryum, ou BBO, est le polymorphe basse température du borate de baryum, composé chimique de formule BaB2O4, également écrite Ba(BO2)2 et BaO·B2O3. Le borate de baryum se présente sous la forme d'une poudre blanche ou de cristaux incolores, souvent à l'état d'hydrate BaB2H2O5. Cet hydrate est un solide blanc peu soluble dans l'eau, tandis que le dihydrate BaB2H4O6, également de couleur blanche[5], perd son eau de cristallisation à 140 °C[6]. Il existe une phase α stable à haute température, la transition β ⟶ α survenant vers 925 °C. Ces deux phases diffèrent par la position des cations de baryum Ba2+ dans le cristal mais sont biréfringentes toutes les deux ; le BBO est un matériau couramment employé en optique non linéaire, par exemple pour réaliser un doublage de fréquence, tandis que la phase α présente une symétrie centrale et donc des propriétés non linéaires différentes[7].
| Borate de baryum | |||
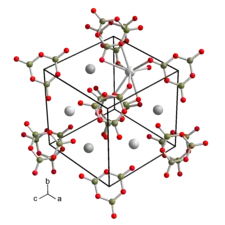
| |||
| __ Ba2+ __ B3+ __ O2− Structure cristalline du borate de baryum. |
|||
| Identification | |||
|---|---|---|---|
| No CAS | , (monohydrate), (dihydrate) |
||
| No ECHA | 100.033.824 | ||
| No CE | 237-222-4 | ||
| PubChem | 6101043, 23165673 (monohydrate) |
||
| SMILES | |||
| InChI | |||
| Apparence | poudre blanche à cristaux incolores | ||
| Propriétés chimiques | |||
| Formule | B2BaO4 | ||
| Masse molaire[1] | 222,947 ± 0,022 g/mol B 9,7 %, Ba 61,6 %, O 28,71 %, |
||
| Propriétés physiques | |||
| T° fusion | 1 051 °C[2] > 900 °C[3] (Monohydrate) |
||
| Masse volumique | 3,35 g·cm-3[3] (Monohydrate) | ||
| Précautions | |||
| SGH[4] | |||
Monohydrate :  Attention |
|||
| NFPA 704[3] | |||
| Transport[3] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Propriétés physiques
L'α-borate de baryum est un matériau optique ayant une fenêtre de transmission optique très large, s'étendant de 190 à 3 500 nm. Il a de bonnes propriétés mécaniques et convient aux applications optiques ultraviolettes de polarisation à grande puissance. Il peut se substituer à la calcite CaCO3, au dioxyde de titane TiO2 ou au niobate de lithium LiNbO3 dans les prismes de Glan-Taylor, les prismes de Glan-Thompson, les miroirs semi-réfléchissants et d'autres composants optiques. Il est faiblement hygroscopique et a une dureté de 4,5 sur l'échelle de Mohs. Il cristallise dans le système trigonal avec le groupe d'espace R3c (no 167) et les paramètres a = b = 723,5 pm et c = 3 919 pm[8].
Le β-borate de baryum, quant à lui, est transparent d'environ 190 à 3 300 nm. Il peut être utilisé comme convertisseur bas. Sa dureté est également de 4,5 sur l'échelle de Mohs. Il cristallise également dans le système trigonal mais avec le groupe d'espace R3c (no 161) et les paramètres a = b = c = 838,0 pm et α = 96,65°[9]. La structure présente trois ions trimériques (BO2)3− presque plans. Chaque atome de baryum est coordonné à huit atomes d'oxygène provenant d'anions voisins. Ses propriétés optiques non linéaires sont près de dix fois supérieures à celles du phosphate de monopotassium KH2PO4. Il peut également être utilisé avec des impulsions laser à très haute densité d'énergie, le seuil d'endommagement (en) du matériau étant de l'ordre de 5 GW/cm2 à 1 064 nm pendant 10 ns.
Le borate de baryum a une forte biréfringence uniaxiale négative et peut être utilisé pour la génération de seconde harmonique de 409,6 à 3 500 nm. Ses indices de réfraction sont peu sensibles à la température, ce qui permet de conserver l'accord de phase sur une gamme de températures larges de 55 °C inhabituellement large.
Préparation
Le borate de baryum peut être obtenu en faisant réagir une solution aqueuse d'acide borique H3BO3 avec de l'hydroxyde de baryum Ba(OH)2. Le γ-borate de baryum obtenu contient de l'eau de cristallisation qui ne peut être entièrement éliminée par séchage à 120 °C mais par chauffage de 300 à 400 °C. La calcination à des températures d'environ 600 à 800 °C consuident à la conversion complète en polymorphe β. Le BBO obtenu de cette manière contient pas de traces de BaB2O2[10].
Les cristaux de BBO destinés aux applications d'optique non linéaire peuvent être obtenus par croissance à partir de flux de borate de baryum, d'oxyde de sodium Na2O et de chlorure de sodium NaCl fondus[11].
Des couches minces de borate de baryum peuvent être déposées par épitaxie en phase vapeur aux organométalliques à partir d'hydrotris(1-pyrazolyl)borate de baryum(II). On obtient différentes phases en fonction de la température de croissance[12]. On peut également préparer du BBO pour les applications photoniques par procédé sol-gel assisté par polyvinylpyrrolidone[13].
Le monohydrate de borate de baryum est obtenu à partir d'une solution de sulfure de baryum BaS et de tétraborate de sodium Na2B4O7. Il peut être utilisé comme additif par exemple dans des retardateurs de flamme, des fongicides ou des inhibiteurs de corrosion.
Le dihydrate est obtenu à partir d'une solution de métaborate de sodium NaBO2 et de chlorure de baryum BaCl2 à une température de 90 à 95 °C ; un précipité blanc se forme lorsque la solution est refroidie à température ambiante. Il perd son eau de cristallisation à 140 °C et peut être utilisé comme retardateur de flamme pour peinture, textile et papier[14].
Propriétés optiques
- Indice de réfraction, 1 064 nm : [15]
- Indice de réfraction, 532 nm :
- Indice de réfraction, 266 nm :
- Transparence (> 0,5 cm−1) : 198–2 600 nm[16]
- Coefficients thermo-optiques[16] :
- ;
- .
- Coefficients optiques non linéaires[17] :
- d22 = 2,3 pV/m ;
- d31 = –0,16 pV/m.
- Seuil de dommage : 10 GW/cm2 pour une largeur d'impulsion de 100 ps à 1 064 nm.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Richard C. Ropp, Encyclopedia of the Alkaline Earth Compounds, Newnes, 2012, p. 511. (ISBN 978-0444595539)
- « Fiche du composé Barium metaborate monohydrate », sur Alfa Aesar (consulté le ).
- Entrée « Barium metaborate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 10 juillet 2021 (JavaScript nécessaire)
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, 93e éd., CRC Press, 2012, p. 50. (ISBN 978-1439880494)
- (en) Dale L. Perry, Handbook of Inorganic Compounds, 2e éd., CRC Press, 2011, p. 498. (ISBN 978-1439814628)
- (en) D. N. Nikogosyan, « Beta barium borate (BBO) », Applied Physics A, vol. 52, no 6, , p. 359-368 (DOI 10.1007/BF00323647, Bibcode 1991ApPhA..52..359N, lire en ligne)
- (en) A. D. Mighell, A. Perloff et S. Block, « The crystal structure of the high temperature form of barium borate, BaO.B2O3 », Acta Crystallographica, vol. 20, no 6, , p. 819-823 (DOI 10.1107/S0365110X66001920, lire en ligne)
- (en) R. Fröhlich, « Crystal structure of the low-temperature form of BaB2O4 », Zeitschrift für Kristallographie, vol. 168, nos 1-4, , p. 109-112 (DOI 10.1524/zkri.1984.168.14.109, Bibcode 1984ZK....168..109F, lire en ligne)
- (en) Sidney D. Ross et Manuel Finkelstein pour MRA Laboratories Inc, Brevet U.S. 4897249A : Barium borate preparation, déposé le 3 avril 1989, publié le 30 janvier 1990, sur Google Patents.
- (en) Devlin M. Gualtieri et Bruce H. T. Chai pour Honeywell International Inc, Brevet U.S. 4931133A : High temperature solution growth of barium borate (β-BaB2O4), déposé le 21 décembre 1988, publié le 5 juin 1990, sur Google Patents.
- (en) G. Malandrino, R. Lo Nigro et I. L. Fragalà, « An MOCVD Route to Barium Borate Thin Films from a Barium Hydro-tri(1-pyrazolyl)borate Single-Source Precursor† », Chemical Vapor Deposition, vol. 13, no 11, , p. 651-655 (DOI 10.1002/cvde.200706611, lire en ligne)
- (en) C. Lu, S. S. Dimov et R. H. Lipson, « Poly(vinyl pyrrolidone)-Assisted Sol−Gel Deposition of Quality β-Barium Borate Thin Films for Photonics Applications », Chemistry of Materials, vol. 19, no 20, , p. 5018-5022 (DOI 10.1021/cm071037m, lire en ligne)
- (en) « Handbook of Organic Compounds », Nature, vol. 177, , p. 639-640 (DOI 10.1038/177639a0, Bibcode 1956Natur.177..639., lire en ligne)
- est l'indice de réfraction expérimental.
- (en) D. N. Nikogosyan, « Beta Barium Borate (BBO) », Applied Physics A: Materials Science & Processing, vol. 52, no 6, , p. 359-368 (DOI 10.1007/BF00323647)
- (en) V.G. Dmitriev, G. G. Gurzadyan et D. N. Nikogosyan, Handbook of Nonlinear Optical Crystals, Berlin, Springer, , 3e éd., 413 p., relié (ISBN 978-3-540-65394-3, LCCN 99017769)
- (en) Kato, K., « Second-harmonic generation to 2048 Å in β-BaB2O4 », IEEE Journal of Quantum Electronics, vol. 22, no 7, , p. 1013-1014 (DOI 10.1109/JQE.1986.1073097)









