Anomalie dilatométrique
L’anomalie dilatométrique est une propriété singulière du comportement de certains corps dont la densité, au lieu d'augmenter continuellement (notamment au cours des changements d'états) pendant leur refroidissement, diminue au contraire à partir d'une température précise, parfois seulement sur certains intervalles de température : autrement dit, dans ces intervalles, le corps se dilate lorsque sa température diminue. L’eau présente une anomalie dilatométrique.
Exemples
Plusieurs éléments chimiques présentent une anomalie de densité : l'antimoine, le bismuth, le gallium, le germanium[1], le plutonium et le silicium ainsi que certains alliages comme le tungstate de zirconium α-ZrW2O8[2] et le cyanure de zinc. Claude Pouillet observait déjà en 1836 que « Dans une certaine étendue de l'échelle thermométrique l'acier trempé se contracte au lieu de se dilater ; c'est une exception remarquable qui tient sans doute à l'état où se trouvent les molécules[3]. » Mais le corps chimique le plus important présentant cette anomalie est encore l'eau[4].
Cas de l'eau
Données empiriques
.svg.png.webp)
Dans les conditions normales de pression, l'eau atteint sa masse volumique maximale d'environ 1 000 kg·m-3 à 3,98 °C. En-dessous de 3,98 °C, l'eau commence à se dilater lorsque la température s'abaisse (y compris au cours du gel). Selon les mesures les plus récentes, le maximum de masse volumique de l'eau serait de (999,974 950 ± 0,000 84 kg·m-3) à une température de 3,983 ± 0,000 67 °C : cet intervalle résulte de la moyenne des résultats obtenus en 2005 par différents instituts de physique allemands.
On peut exprimer la loi de variation de la masse volumique ρLF de l’eau exempte d’oxygène dissous en fonction de la température T (exprimée ici en °C) grâce à l'équation du viriel :
où les coefficients ont pour valeur :
- a0 = 999,839 52 kg·m-3 ;
- a1 = 16,952 577 kg·m-3·°C-1 ;
- a2 = −7,990 512 7×10-3 kg·m-3·°C-2 ;
- a3 = −4,624 175 7×10-5 kg·m-3·°C-3 ;
- a4 = 1,058 460 1×10-7 kg·m-3·°C-4 ;
- a5 = −2,810 300 6×10-10 kg·m-3·°C-5 ;
- et b = 0,016 887 2 °C-1.
Quant à la masse volumique de l'eau saturée en air dissous, on peut corriger l'équation précédente de la façon suivante[5] :
- .
Mécanisme
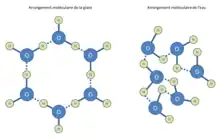
À l’état solide (dans le cas de l'eau on parle alors évidemment de « glace »), la cristallisation aboutit à un empilement ordonné de molécules formant un véritable réseau cristallin. À l’état liquide, la même quantité de molécules occupe en principe un volume plus grand du fait des vitesses élevées des molécules et de l’existence d’un libre parcours moyen. Et puisque le volume augmente, la densité doit diminuer (la masse étant constante). Le chaos devient extrême à l’état gazeux : les molécules s’éloignent en moyenne au maximum de manière à remplir le plus uniformément possible le volume disponible.
L’explication de l’anomalie dilatométrique de l’eau réside dans la formation de chaînes moléculaires par liaison par pont hydrogène. Du fait de la formation spécifique de ces chaînes, l’édifice cristallin solide prend plus de place que les molécules disjointes et mobiles de l’état liquide. La solidification est un processus graduel, ce qui veut dire qu’à l’état liquide il existe déjà des agrégats de molécules d'eau liées. À 3,98 °C l’eau se trouve dans un état où ces agrégats occupent un volume minimum : sa masse volumique est alors maximale. Lorsque l’on continue d’abaisser la température, l’évolution continue de la structure cristalline exige de plus en plus de place ; lorsqu’au contraire on élève la température, l’agitation moléculaire donne naissance à un libre parcours moyen non nul, qui se traduit par une apparente dilatation.
Conséquence pour la limnologie
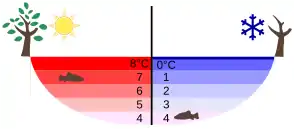
L'anomalie dilatométrique de l'eau joue un rôle considérable pour la survie des espèces lacustres des zones glaciales. Ainsi en raison de cette anomalie dilatométrique, en-dessous d'une température de 4 °C les eaux froides de surface ne convectent plus vers le bas, ce qui empêche le refroidissement des eaux plus profondes. Il y a inversion de la stratification thermique entre l'été et l'hiver (voir illustration ci-contre), donnant, l'hiver, naissance à une couche d'inversion : les eaux profondes restent relativement isothermes, et animaux et plantes peuvent, jusqu'à un certain point, survivre sous la glace.
Notes et références
- Le germanate de cuivre et fer Cu2Fe2Ge4O13, monoclinique et constitué de chaînes d'octaèdres FeO6 en zigzag ; il présente un coefficient de dilatation thermique unidirectionnel négatif entre 40 K et 200 K ; cf. (en) G.J. Redhammer, M. Merz, G. Tippelt, K. Sparta, G. Roth, W. Treutmann, W. Lottermoser et G. Amthauer, « Temperature-dependent crystal structure refinement and 57Fe Mössbauer spectroscopy of Cu2Fe2Ge4O13 », Acta Cryst. B, vol. 63, no 1, , p. 4-16 (DOI 10.1107/S0108768106051652).
- Cet alliage se contracte lorsque la température augmente entre - 272,85 °C et 777 °C, température à laquelle le matériau se dissocie. Ce phénomène a aussi été observé pour d'autres membres de la famille AM2O8 (A = Zr ou Hf et M = Mo ou W) ; cf. à ce sujet (en) L.D. Noailles, H.-h. Peng, J. Starkovich et B. Dunn, « Thermal Expansion and Phase Formation of ZrW2O8 Aerogels », Chem. Mater., vol. 16, no 7, , p. 1252–1259 (DOI 10.1021/cm034791q).
- Cité d'après Claude Pouillet, Élémens de physique expérimentale et de météorologie, Bruxelles, Louis Haumant et Co., , Livre II - De la chaleur, « V - De la dilatation des solides », p. 108. .
- La dilatation de l'eau entre 4 °C et 0 °C a été décrite par Hippolyte Fizeau en 1866 : voir la bibliographie ci-après.
- D'après H. Bettin et F. Spieweck, « Die Dichte des Wassers als Funktion der Temperatur nach Einführung der Internationalen Temperaturskala von 1990 », PTB-Mitteilungen, 100e série, no 3, , p. 195.
Voir aussi
Bibliographie
- Hippolyte Fizeau, « Mémoire sur la dilatation des corps solides par la chaleur », Comptes Rendus des Séances de l'Académie des Sciences, Paris, vol. 62, , p. 1101-1106, 1133-1148.
- B. Dussart, Limnologie – L'étude des eaux continentales, Paris, Gauthier-Villars, (réimpr. 1992, éd. Boubée), 678 p..
- A. Hade, Nos lacs – les connaître pour mieux les protéger, Éditions Fides, , 360 p..

