Éléphant de forêt d'Afrique
Loxodonta cyclotis

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Mammalia |
| Sous-classe | Theria |
| Infra-classe | Eutheria |
| Ordre | Proboscidea |
| Famille | Elephantidae |
| Genre | Loxodonta |
CR A2abd :
En danger critique
2021
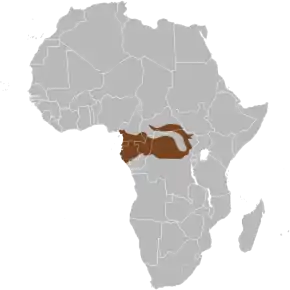
Répartition géographique
Statut CITES
Statut CITES
Botswana, Namibie, Rep. Démocratique du Congo, Afrique du Sud, Zimbabwe, Rep. de Tanzanie uniquement
Statut CITES
L'éléphant de forêt d'Afrique (Loxodonta cyclotis) est un mammifère mégaherbivore de la famille des Éléphantidés, plus petit que les autres éléphants d'Afrique et typiquement forestier (bien qu'épisodiquement aussi présent en zone de transition vers la savane[1]). C'est l'une des deux espèces du genre Loxodonta (et des trois espèces d'éléphants existant actuellement). Cette espèce est moins connue que celle de l'éléphant de savane en raison d'obstacles écologiques et politiques, qui l'ont rendue plus difficile à étudier et à protéger.
Elle a disparu d'au moins 75 % de son aire naturelle de répartition et, là où elle est encore présente, elle régresse à un rythme alarmant, alors que les chercheurs montrent qu'elle joue un rôle écologique très important[2]. Ses populations sont fragmentées et ont chuté de 62 % de 2002 à 2011[1]. Elles ne sont plus, vers 2015, que le dixième de ce qu'elles étaient historiquement[1]. Sa régression semble toujours liée aux activités humaines[3] (chasse, déforestation notamment). En tant que mégaherbivore consommant un grand nombre de plante et producteur de bouses, il a une influence importante sur l'écosystème forestier et son faciès.
Caractéristiques
L'éléphant de forêt d'Afrique a des oreilles généralement plus petites et plus circulaires que l'autre espèce africaine. Il a également des défenses plus minces et plus droites. Les mâles mesurent entre 5,5 et 7,5 m de long, 2,5 et 3,5 m au garrot et pèsent de 4 à 6 t, tandis que les femelles, plus petites, mesurent entre 4 et 5 m de long, 1,5 et 2,5 m au garrot et pèsent entre 2 et 3,5 t.
Écologie et comportement
Comportement
Les éléphants de forêt, comme leurs cousins de savane ou d'Asie, sont très sociaux mais évoluent en groupes bien plus petits (y compris par rapport aux éléphants d'Asie vivant en forêt humide en Malaisie) ; les femelles adultes sont généralement suivies d'un ou plusieurs jeunes et les mâles adultes sont souvent plutôt solitaires. Le groupe rassemble 2,8 individus en moyenne et l'unité familiale 3,5 individus[4].
Alimentation
Son alimentation est très variée. À titre d'exemple, au moins 307 aliments différents ont été mangés par un groupe observé durant sept ans (1984-1991) dans une forêt gabonaise de basse altitude (réserve de la Lopé) ; les feuilles et écorces constituaient 70 % de tous les éléments observés, à 73 % collectées sur des arbres. Les éléphants de forêt consomment aussi beaucoup plus de fruits que leurs cousins de savane (72 espèces consommées ; et les restes d'au moins une espèce de fruit ont été identifiés dans 82 % des 311 crottins frais examinés durant une année complète)[4]. Cette espèce est réellement dépendante de la forêt (et notamment des fruits d'arbres forestiers) pour se nourrir ; selon une étude faite au Ghana, « L'hypothèse que les éléphants migrent de la forêt primaire humide dans les zones agricoles et les forêts secondaires pour se nourrir durant la saison des pluies ne peut se baser sur des constatations convaincantes »[5].
Importance écosystémique et pour le climat
Cette espèce est en régression préoccupante et récemment accélérée[1] alors qu’elle a des fonctions écosystémiques importantes : beaucoup de graines de plantes et d’arbres ne germent qu’après être passées par son tube digestif, et on a démontré, en 2019, qu’elle contribue à fortement améliorer la capacité de puits de carbone des forêts africaines où elle survit[2].
Un éléphant de forêt africain mange beaucoup : jusqu’à 450 kg de plantes, en sillonnant le sous-bois. Il y mange des fruits dont il sème les graines. Il mange aussi une grande quantité de feuilles et de jeunes branches ainsi que des écorces de jeunes troncs (mais jamais de plus de à 30 centimètres de diamètre). Ce faisant il tue certains arbres et en fragilise d'autres[2]. Des chercheurs ont construit un modèle prédictif de ce à quoi ressemblerait une forêt après des années de circulation d'éléphants qui n’auraient consommé que des plantes de petite taille ou que des branches de faible diamètre. Le résultat montre qu’en réponse à la pression de sélection que constitue le comportement alimentaire des éléphants, les arbres à croissance lente (typiquement des essences à bois dur et très tolérantes à l'ombre) se développent mieux, car elles sont moins concurrencées par d'autres plantes et essences pour l'eau et la lumière (sélection naturelle). Selon ce modèle, et contre-intuitivement, cette consommation diffuse mais importante de gros végétaux conduit en fait à un accroissement de la biomasse végétale, bénéfique pour la forêt et bénéfique contre le changement climatique, car augmentant aussi le puits de carbone forestier.
Les prédictions du modèle se vérifient dans la forêt réelle. Là où les éléphants vivent encore en forêt, les arbres sont effectivement d'essences nettement plus dense (plus denses de 75 grammes par mètre cube que ceux des forêts sans éléphants). Un seul éléphant par kilomètre carré suffit donc à augmenter la masse végétale d'un hectare de forêt de 60 tonnes, ce qui permettrait (extrapolation) aux 2,2 millions de kilomètres carrés de forêts d'Afrique d’absorber 10 milliards de tonnes de dioxyde de carbone de plus[2]. Plus les éléphants disparaitront, moins ces forêts contiendront de bois précieux (bois durs qui contiennent le plus de carbone et se dégradent moins vite) et moins elles contribueront à la lutte contre le changement climatique[2].
La présence de l’éléphant forestier explique d’importantes différences entre les faciès et écosystèmes forestiers de l’Amazonie et de l’Asie. Il a modifié le paysage intraforestier en favorisant des arbres plus petits et compacts, même là où les conditions climatiques et les sols semblent identiques. Une expérience, dont les résultats ont été publiés en 2019[6], a consisté à apporter des bouses d'éléphant sur des parcelles et à comparer leur évolution avec une parcelle témoin. Elle a montré qu'après un an, pour 439 plants de 12 espèces qui y sont apparus, on n'a pas constaté de différence de survie d'espèces végétales jeunes (douze espèces) et tolérantes à l'ombre (dix-neuf espèces) ni dans la vitesse de croissance, mais l'apport de bouse d'éléphant forestier a augmenté le nombre de feuilles chez les plantes tolérantes à l’ombre (typiques des milieux fréquentés par cet éléphant) dès le stade plantule. L'éléphant favorise donc ces espèces. Le recul ou la disparition ou le retour de cet éléphants modifierait le faciès des forêts africaines.
Il crée ou entretient des corridors intraforestiers utilisés par d'autres espèces et favorise des arbres plus feuillus, plus petits et produisant un bois plus dense. Après leur réintroduction dans des forêts anthropisées ou là où il a disparu depuis des décennies, on suppose qu’il faudra néanmoins quelques siècles pour retrouver le faciès et les essences antérieurement dominantes[2]. L'éléphant forestier d'Afrique apparait donc maintenant clairement comme une espèce facilitatrice, si ce n'est une espèces ingénieur, à mobiliser comme solution inspirée par la nature pour protéger la capacité des forêts tropicale africaine à produire des bois durs (les plus recherchés en tant que bois précieux) et pour lutter contre le changement climatique. Jusqu'à la fin de la dernière glaciation, outre des mammouths, des éléphants vivaient aussi en Europe et Amérique du nord. Ces données nouvelles sur les éléphants forestiers pourraient éclairer les études sur les paléopaysages et paléoécosystèmes et sur l'importance de la grande faune dont les effets écosystémiques sont encore incomplètement cernés.
Habitat et répartition
Ils se rencontrent généralement en forêt dense d'Afrique centrale et d'Afrique de l'Ouest, mais on les trouve aussi parfois en bord de territoire forestier, comme les éléphants de savane.
Éthologie
L'éléphant de forêt d'Afrique vit en société à dynamique de fission-fusion.
Classification
Les différents éléphants africains ont longtemps été considérés comme des représentants de sous-espèces du taxon Loxodonta africana. Des études génétiques datant de 2001 ont permis de démontrer que les deux principales sous-espèces africaines Loxodonta africana africana et Loxodonta africana cyclotis étaient en fait deux espèces distinctes : en Afrique, il convient donc de distinguer désormais l’éléphant de la savane, Loxodonta africana, et l’éléphant des forêts, Loxodonta cyclotis[7] - [8]. Quelques cas d'hybridation avec l'éléphant de savane semblent exister là où les aires de répartition se jouxtent ou se superposent[9].
L'espèce et l'humain
Hypothèse d'utilisation historique

Les Carthaginois adoptèrent en 278 av. J.-C. l'utilisation de l'éléphant de guerre après leur affrontement cette même année en Sicile contre l'armée de Pyrrhus Ier. Ils en alignèrent par dizaines dans leur armée, notamment lors des première et deuxième guerre punique. La figuration d'éléphant sur les monnaies carthaginoises de cette époque permet selon Philippe Leveau[10] d'identifier un éléphant de forêt, caractérisé par une trompe annelée et non lisse, de grands pavillons et une croupe rebondie. Son habitat était signalé par Hérodote dans le sud de l'actuelle Tunisie[11], dans les régions côtières du Maroc selon le Périple d'Hannon et par Pline l'Ancien au pied de l'Atlas marocain[12]. Ces diverses régions d'Afrique du Nord avaient alors une couverture boisée plus importante qu'actuellement.
Polybe affirme à propos de la bataille de Raphia (217 av. J.-C.) que « la plupart des éléphants craignirent le combat, ce qui est assez ordinaire aux éléphants d'Afrique. Ils ne peuvent soutenir ni l'odeur ni le cri de ceux des Indes, ou, plutôt, je crois que c'est la grandeur et la force de ceux-ci qui les épouvantent et leur font prendre la fuite avant même qu'on les en approche »[13]. En effet l'éléphant d'Asie est plus grand que l'éléphant des forêts . Cependant, une analyse ADN a montré que les éléphants d'Érythrée sont des éléphants de savane, plus grands que ceux d'Asie, ce qui infirmerait l'explication de Polybe[14] - [15].
Selon Jean-Pascal Jospin, l'éléphant des forêts aurait pu disparaître de ces régions en raison du recul de la forêt, et de la chasse systématique pratiquée durant l'Empire romain pour approvisionner les amphithéâtres en bêtes de cirque[16]
État des populations, menaces, pressions
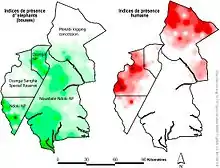
À gauche (et en vert) : Indices de présence d'éléphant de forêt. À droite (et en rouge) : indices de présence humaine sur le même territoire.
Cette espèce, traditionnellement chassée par les peuples pygmées, a longtemps été protégée dans le bassin du Congo par la difficulté de pénétration de son milieu très enforesté.
Cela change progressivement avec la construction de routes forestières et de nombreuses pistes forestières qui facilitent grandement la pénétration de braconniers et de leurs équipements. Une étude publiée en 2007 a montré que les signes de présence de chasseurs augmentent quand on se rapproche des routes et que le nombre des animaux décroit jusqu'à 40 km de routes principales[17]. Selon William F. Laurance, ces effets « sont parmi les pires des maux apparus dans la boîte de Pandore des impacts routiers[18]. »
Sur la carte ci-contre on voit que cette espèce d'éléphant tend à fuir la présence humaine et/ou que le braconnage l'a déjà éliminé à proximité des routes forestières et des établissements humains[17].
Les zones rouges correspondent toutes à des zones desservies par des routes forestières[17]. Plus on est proche d'une route, moins on a de chance d'observer un éléphant vivant, et plus le risque de braconnage augmente. Selon les auteurs : l'abondance et la diversité des éléphants de forêt sont menacés par le braconnage qui est le plus intense à proximité des routes forestières[17]. La probabilité de présence d'éléphants a augmenté avec la distance aux routes, alors que celle des signes humains a diminué. À toutes les distances des routes, la probabilité d'occurrence d'éléphants était toujours plus élevée à l'intérieur qu'à l'extérieur des aires protégées, alors que celle de l'homme était toujours plus faible. À l'intérieur des zones protégées, la densité des éléphants de forêt a été corrélée avec la taille du noyau de forêt à distance, mais pas avec la taille de la zone protégée[17].
Selon les auteurs de cette étude, appuyée par la Wildlife Conservation Society de New York, il y a urgence, « les éléphants de forêt doivent être prioritairement pris en compte dans la planification de la gestion des éléphants à l'échelle continentale »[17] en tenant mieux compte de la menace que constituent les routes pour les espèces sauvages vulnérables au braconnage.
L’espèce a perdu, en 10 ans, près de 80 % de sa population dans un vaste parc pourtant sanctuarisé, au Gabon, son principal pays d'accueil[19].
Le 25 Mars 2021, il est classé comme en « danger critique d'extinction » par l'Union internationale pour la conservation de la nature[20]. L'organisation souligne que sa population a chuté de 86 % entre 1990 et 2021[21].
Notes et références
- Maisels & al. (2013) Devastating decline of forest elephants in central Africa. PLoS One. 8:e59
- Frederick E(2019) Hungry elephants fight climate change one mouthful at a time | 15 juillet | Nature Geoscience ; doi:10.1126/science.aay7463.
- Buij, R., McShea, W. J., Campbell, P., Lee, M. E., Dallmeier, F., Guimondou, S., ... & Nichols, J. D. (2007). Patch-occupancy models indicate human activity as major determinant of forest elephant Loxodonta cyclotis seasonal distribution in an industrial corridor in Gabon. Biological Conservation, 135(2), 189-201.
- White, L. J., Tutin, C. E., & FERNANDEZ, M. (1993). Group composition and diet of forest elephants, Loxodonta africana cyclotis Matschie 1900, in the Lopé Reserve, Gabon. African Journal of Ecology, 31(3), 181-199 |résumé.
- Short, J. C. (1983). Density and seasonal movements of forest elephant (Loxodonta africana cyclotis, Matschie) in Bia National Park, Ghana. African Journal of Ecology, 21(3), 175-184 (résumé)
- Kalbitzer, U., McInnis, V., Omeja, P. A., Bortolamiol, S., & Chapman, C. A. (2019). Does the presence of elephant dung create hotspots of growth for existing seedlings?. Journal of Tropical Ecology, 35(3), 132-139 |résumé.
- Alfred L. Roca, Nicholas Georgiadis, Jill Pecon-Slattery et Stephen J. O'Brien, « Genetic Evidence for Two Species of Elephant in Africa », 24 August 2001, Science (revue) 293 (5534), 1473. résumé
- Grubb P, Groves C.P, Dudley J.P & Shoshani J (2000) Living African elephants belong to two species: Loxodonta africana (Blumenbach, 1797) and Loxodonta cyclotis (Matschie, 1900) | Elephant, 2(4), 3.
- Groves, C. P., & Grubb, P. (2000). Do Loxodonta cyclotis and L. africana interbreed ?. Elephant, 2(4), 4.
- Philippe Leveau, Le franchissement du Rhône par Hannibal : le chenal et la navigation fluviale à la fin de l’Âge du Fer, Revue archéologique, no 35, P.U.F., 2003/3, pp. 42 et suivantes (ISBN 978-2-88474-244-3)
- Hérodote, Histoires, IV, 191
- Pline l'Ancien, Histoires naturelles, VIII, 5
- Polybe, Histoires [détail des éditions] [lire en ligne], V.
- (en) Tia Goose, « Mystery Of Elephants In Ancient Syrian Battle Solved At Last », sur HuffPost, (consulté le )
- (en) Claire Sturgeon, « War Elephant Myths Debunked by DNA », sur Carl R. Woese Institute for Genomic Biology, Université de l'Illinois à Urbana-Champaign, (consulté le )
- Jean-Pascal Jospin, Les blindés d'Hannibal : quels éléphants ?, publié dans Hannibal et les Alpes, Infolio, 2011, (ISBN 978-2-88474-244-3), pp. 109-110
- (en) S. Blake et al., « Forest elephant crisis in the Congo Basin », PLoS Biol, no 5(4):e111, (DOI 10.1371/journal.pbio.0050111)
- (en) W.F. Laurance, « Wildlife struggle in an increasingly noisy world », PNAS, vol. 112, no 39, (lire en ligne).
- https://www.sciencesetavenir.fr/animaux/grands-mammiferes/le-declin-des-elephants-de-foret-d-afrique-a-ete-sous-estime-au-gabon_110715
- Australia) Charles Edwards (CSIRO (Commonwealth Scientific and Industrial Research Organisation) et Russell Taylor (IUCN SSC African Elephant Specialist Group), « IUCN Red List of Threatened Species: Loxodonta cyclotis », sur IUCN Red List of Threatened Species, (consulté le )
- Emmanuel Clévenot, « Les éléphants d'Afrique sont « en danger d’extinction » », sur Reporterre,
Voir aussi
Références taxonomiques
- (en) Référence Catalogue of Life : Loxodonta cyclotis (Matschie, 1900) (consulté le )
- (en) Référence CITES : espèce Loxodonta africana Matschie, 1900 (+ répartition sur Species+) (consulté le )
- (fr+en) Référence ITIS : Loxodonta cyclotis (Matschie, 1900)
- (en) Référence Animal Diversity Web : Loxodonta cyclotis
- (en) Référence NCBI : Loxodonta cyclotis (taxons inclus)
- (en) Référence Fonds documentaire ARKive : Loxodonta cyclotis
- Deux nouvelles espèces d’éléphant, site du Musée de zoologie de Lausanne.
Articles connexes
Bibliographie
- Günter Merz (1981) Recherches sur la biologie de nutrition et les habitats préférés de l’éléphant de forêt, Loxodonta africana cyclotis Matschie, 1900. Mammalia, 45(3), 299-312.
- Kalbitzer, U., McInnis, V., Omeja, P. A., Bortolamiol, S., & Chapman, C. A. (2019), Does the presence of elephant dung create hotspots of growth for existing seedlings? (résumé), Journal of Tropical Ecology, 35(3), 132-139.
- Ngama, S., Bindelle, J., Poulsen, J. R., Hornick, J. L., Linden, A., Korte, L., ... & Vermeulen, C. (2019). https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0213971 Do topography and fruit presence influence occurrence and intensity of crop-raiding by forest elephants (Loxodonta africana cyclotis)?]. PloS one, 14(3), e0213971.
- Pardo, M. A., Poole, J. H., Stoeger, A. S., Wrege, P. H., O’Connell-Rodwell, C. E., Padmalal, U. K., & de Silva, S. (2019). Differences in combinatorial calls among the 3 elephant species cannot be explained by phylogeny. Behavioral Ecology, 30(3), 809-820.
- Vogel, S. M., de Boer, W. F., Masake, M., Songhurst, A. C., McCulloch, G., Stronza, A., ... & Coulson, T. (2019). Do African savanna elephants (Loxodonta africana) eat crops because they crave micronutrients?. bioRxiv, 673392.
- Short J.C (1983), Density and seasonal movements of forest elephant (Loxodonta africana cyclotis, Matschie) in Bia National Park, Ghana, African Journal of Ecology, 21(3), 175-184 (Résumé).