Trichloroacétonitrile
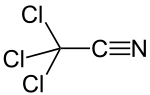
Le trichloroacétonitrile est un composé organique de formule CCl3CN. C'est un liquide incolore, même si les échantillons commerciaux sont souvent marronâtres.
| Trichloroacétonitrile | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | trichloroacétonitrile | ||
| Synonymes |
trichloroéthanonitrile |
||
| No CAS | |||
| No ECHA | 100.008.078 | ||
| No CE | 208-885-7 | ||
| PubChem | 24900271 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore à l'odeur caractéristique[1] | ||
| Propriétés chimiques | |||
| Formule | C2Cl3N [Isomères] |
||
| Masse molaire[2] | 144,387 ± 0,008 g/mol C 16,64 %, Cl 73,66 %, N 9,7 %, |
||
| Propriétés physiques | |||
| T° fusion | −42 °C[1] | ||
| T° ébullition | 85,7 °C[1] | ||
| Masse volumique | 1,44 g·cm-3 (20 °C)[1] | ||
| Point d’éclair | 195 °C[1] | ||
| Pression de vapeur saturante | 77 mbar (20 °C)[1] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,441[3] | ||
| Précautions | |||
| SGH[3] - [1] | |||
  Danger |
|||
| NFPA 704[3] | |||
| Transport[3] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 250 mg/kg (oral, rat)[4] 1300 mg/kg (lapin dermique)[4] |
||
| LogP | 2,09[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Propriétés[1]
Le trichloroacétonitrile est un liquide combustible, modérément soluble dans l'eau. Il est plus lourd que l'eau et très volatil. Il se décompose lorsqu'il est chauffé, notamment en chlorure d'hydrogène, oxydes d'azote et cyanure d'hydrogène.
Synthèse
Le trichloroacétonitrile est préparé par déshydratation du trichloroacétamide[5]
Utilisations
Il est utilisé commercialement comme précurseur de l'étridiazole, un fongicide.
En recherche académique, le trichloroacétonitrile est utilisé comme réactif dans le réarrangement d'Overman qui convertit les alcools allyliques en amines allylique[6] - [7] - [8].
Notes et références
- Entrée « Trichloroacetonitrile » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 8 décembre 2012 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Trichloroacetonitrile, consultée le 8 décembre 2012.
- American Industrial Hygiene Association Journal. Vol. 23, Pg. 95, 1962.
- Peter Pollak, Gérard Romeder, Ferdinand Hagedorn, Heinz-Peter Gelbke “Nitriles” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI 10.1002/14356007.a17_363
- (en) T. Nishikawa, M. Asai, N. Ohyabu, M. Isobe, « Improved Conditions for Facile Overman Rearrangement(1) », J. Org. Chem., vol. 63, no 1, , p. 188–192 (PMID 11674062, DOI 10.1021/jo9713924)
- (en) « Overman Rearrangement », Organic Chemistry Portal, organic-chemistry.org (consulté le )
- (en) Y. K. Chen. A. E. Lurain, P. J. Walsh, « A general, highly enantioselective method for the synthesis of D and L alpha-amino acids and allylic amines », J. Am. Chem. Soc., vol. 124, no 41, , p. 12225–12231 (PMID 12371863, DOI 10.1021/ja027271p)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Trichloroacetonitrile » (voir la liste des auteurs).


