Tétrafluoroborate de sodium
Le tétrafluoroborate de sodium est un composé chimique de formule NaBF4. Il s'agit d'un sel incolore cristallisé très soluble dans l'eau mais un peu moins dans les solvants organiques[3]. Il est utilisé comme flux de brasage ainsi que pour produire du trifluorure de bore[4] BF3.
| Tétrafluoroborate de sodium | |
 |
|
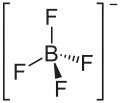
| Structure du tétrafluoroborate de sodium | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.033.931 |
| No CE | 237-340-6 |
| No RTECS | ED2975000 |
| PubChem | 4343483 |
| SMILES | |
| InChI | |
| Apparence | solide incolore cristallisé[1] |
| Propriétés chimiques | |
| Formule | BF4Na |
| Masse molaire[2] | 109,794 ± 0,007 g/mol B 9,85 %, F 69,21 %, Na 20,94 %, |
| Propriétés physiques | |
| T° fusion | 384 °C[1] |
| Solubilité | 1,08 kg·L-1[1] à 26 °C |
| Masse volumique | 2,47 g·cm-3[1] à 20 °C |
| Précautions | |
| SGH[1] | |
 Danger |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
On peut produire le tétrafluoroborate de sodium en neutralisant l'acide tétrafluoroborique HBF4 avec le carbonate de sodium Na2CO3 ou l'hydroxyde de sodium NaOH[5] :
On peut également le produire en faisant réagir de l'acide borique H3BO3, de l'acide fluorhydrique HF(aq) et du carbonate de sodium[4] :
Lorsqu'on le chauffe jusqu'à son point de fusion, le tétrafluoroborate de sodium se décompose en NaF et trifluorure de bore[6] BF3 :
Ce composé est une source d'anion tétrafluoroborate [BF4]−, utilisé pour la préparation de sels en chimie organique, ainsi que pour la production de liquides ioniques.
Notes et références
- Entrée « Sodium tetrafluoroborate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13 octobre 2018 (JavaScript nécessaire).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) G. W. A Milne, Gardner's Commercially Important Chemicals: Synonyms, Trade Names, and Properties, 2005. (ISBN 9780471735182).
- (en) Georg Brauer, Handbook of Preparative Inorganic Chemistry vol. 1, 2e édition, Academic Press, New York, 1963, p. 220-222. (ISBN 978-0121266011).
- (en) Mary Eagleson, (1994). Concise Encyclopedia Chemistry, 1994. (ISBN 9783110114515).
- (en) Richard j. Lewis, Hazardous Chemicals Desk Reference, 2008. (ISBN 9780470334454).
