Superoxyde de potassium
Le superoxyde de potassium ou dioxyde de potassium, est un composé chimique de formule brute KO2. Il s'agit d'un solide jaune résultant de la combustion du potassium fondu dans l'oxygène pur. Ce sel rare de l'anion superoxyde O2− est utilisé industriellement pour l'élimination du CO2, comme agent oxydant, agent dessiccant, ainsi que dans les recycleurs et les systèmes de support de vie pour sous-marins, engins spatiaux et combinaisons spatiales.
| Superoxyde de potassium | |||
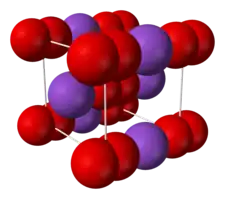 Maille cristalline de superoxyde de potassium |
|||
| Identification | |||
|---|---|---|---|
| Synonymes |
dioxyde de potassium |
||
| No CAS | |||
| No ECHA | 100.031.574 | ||
| No CE | 234-746-5 | ||
| No RTECS | TT6053000 | ||
| PubChem | 61541 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre jaune[1] | ||
| Propriétés chimiques | |||
| Formule | KO2 [Isomères] |
||
| Masse molaire[2] | 71,097 1 ± 0,000 7 g/mol K 54,99 %, O 45,01 %, |
||
| Propriétés physiques | |||
| T° fusion | 380 °C[1] | ||
| Masse volumique | 2,14 g·cm-3[1] | ||
| Précautions | |||
| SGH[3] - [4] | |||
  Danger |
|||
| Transport[3] - [4] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Les principales réactions impliquant le superoxyde de potassium dans les systèmes de support de vie sont :
- 4 KO2 + 2 H2O → 4 KOH + 3 O2 : libération d'oxygène sous l'effet de l'humidité.
- 4 KOH + 2 CO2 → 2 K2CO3 + 2 H2O : libération d'eau par fixation du dioxyde de carbone.
Somme des deux premières réactions: 4 KO2 + 2 CO2 → 2 K2CO3 + 3 O2 : libération d'oxygène par réaction du dioxyde de carbone.
S'il y a assez de CO2 et d'eau:
total général:
Le superoxyde de potassium a été utilisé par l'Agence spatiale fédérale russe dans ses scaphandres et le module Soyouz. Il a également été utilisé dans les recycleurs par des équipes de pompiers et pour le sauvetage minier, mais n'est pas utilisé dans les scaphandres autonomes pour la plongée sous-marine en raison des risques d'explosion au contact de l'eau. KO2 a une capacité d'absorption théorique de 618 g de CO2 par kilogramme d'absorbant avec libération théorique de 338 g d'O2, soit 4 molécules de CO2 pour 3 molécules d'O2. Cependant, le corps humain consomme une molécule d'O2 pour produire chaque molécule de CO2 et d'autres molécules d'O2 pour produire de l'eau et de l'urée par oxydation des lipides et des protéines. Donc il a besoin de plus de molécules d'O2 qu'il ne souffle de molécule de CO2 (sauf s'il boit des boisons gazeuses ou ajoute du CO2 autrement).
Structure
Le superoxyde de potassium cristallise dans le système réticulaire trigonal avec comme paramètres de maille a = 570,4 ± 0,5 pm, c = 669,9 ± 0,5 pm. La longueur de la liaison O-O est de 128 ± 2 pm et les deux types de contact K-O sont de longueur 271 et 292 pm[5].
Tendance des liaisons entre deux oxygènes
Les liaisons entre deux oxygènes, ont des distances O-O corrélées avec leur ordre de liaison.
| Type de liaison dioxygène | nom | distance O-O en pm | ordre de liaison |
|---|---|---|---|
| O2+ | dioxygényle | 112 | 2,5 |
| O2 | dioxygène | 121 | 2 |
| O2− | superoxyde | 128 | 1,5[5] |
| O22− | peroxyde | 149 | 1 |
Notes et références
- « Fiche Superoxyde de potassium », Merck [PDF] (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- S. C. Abrahams and J. Kalnajs, The crystal structure of α-potassium superoxide, Acta Crystallographica, 1955, vol.8, pp. 503-506. DOI 10.1107/S0365110X55001540.
