Bicarbonate de potassium
Le bicarbonate de potassium, ou hydrogénocarbonate de potassium, ou encore carbonate acide de potassium, est un sel basique incolore et inodore. Les cristaux monocliniques, de densité 2,17 se décomposent entre 100 °C et 200 °C.
| Bicarbonate de potassium | |

| |
| Identification | |
|---|---|
| Synonymes |
hydrogénocarbonate de potassium |
| No CAS | |
| No ECHA | 100.005.509 |
| No CE | 206-059-0 |
| DrugBank | DB11098 |
| PubChem | 516893 |
| ChEBI | 81862 |
| No E | E501(ii) |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores transparents, poudre ou granulés blancs |
| Propriétés chimiques | |
| Formule | KHCO3 |
| Masse molaire[1] | 100,115 1 ± 0,001 9 g/mol C 12 %, H 1,01 %, K 39,05 %, O 47,94 %, 100,1 g/mol |
| Propriétés physiques | |
| T° fusion | 100 à 200 °C (décomposition) |
| Solubilité | 322 g·l-1 dans l'eau (20 °C) Insoluble dans l'alcool, dans l'alcool à 95° saturé en K2CO3 |
| Masse volumique | 2,17 g·cm-3 |
| Cristallographie | |
| Système cristallin | monoclinique |
| Propriétés optiques | |
| Indice de réfraction | 1,482 |
| Précautions | |
| SGH | |
 Attention |
|
| NFPA 704 | |
| Peau | Légèrement irritant Laver avec de l’eau et du savon |
| Yeux | Légèrement irritant Laver à l’eau pendant 15 min |
| Écotoxicologie | |
| DL50 | >2 000 mg·kg-1 rats, oral |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
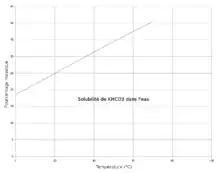
Ce sel carbonaté KHCO3 est moyennement soluble dans l'eau. Pour 100 g d'eau pure, on en peut dissoudre au maximum 22,4 g à 0 °C (eau froide), 27,7 g à 10 °C, 33,2 g à 20 °C, 39,1 g à 30 °C, 45,4 g à 40 °C et jusqu'à 60 g à 60 °C (eau chaude).
Le bicarbonate de potassium impur se décompose entre 100 °C et 120 °C pour donner du carbonate de potassium, de l'eau et du dioxyde de carbone.
Il est considéré comme inoffensif pour la santé, du moins à faible dose.
Fabrication
Il est fabriqué en faisant réagir du carbonate de potassium, de l'eau et du dioxyde de carbone :
Utilisations
- Source de dioxyde de carbone
- Extincteurs : Concernant les poudres sèches anti-incendie, il est deux fois plus efficace que le bicarbonate de sodium, même s'il est employé souvent en mélange avec lui. Utilisé pour les feux de classes B et C, dans le secteur de l’automobile.
- Levure chimique : il se décompose sous l'effet de la température, à l'instar du bicarbonate de sodium .
- Gazéification des eaux gazeuses. Le CO2 est libéré grâce à de l'acide citrique.
- Comprimés effervescents : ils se désagrègent dans un verre d'eau
- Régulateur de pH
- Pour neutraliser les sols acides
- Régulateur alimentaire de pH
- Œnologie : se combine avec l'acide tartrique pour donner des sels insolubles. 1 g·l-1 de KHCO3 fait chuter l'acidité de 0,49 g·l-1H2SO4
- Antiacide (Digestive biscuit)
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Oïdium - Jardinage durable en Australie
- Utilisation du bicarbonate de potassium comme fongicide dans l'agriculture biologique


