Relargage du méthane de l'Arctique
Le relargage du méthane de l'Arctique désigne plusieurs formes de rejet du méthane contenu dans les mers, les écosystèmes sous-glaciaires et les sols du pergélisol arctique.
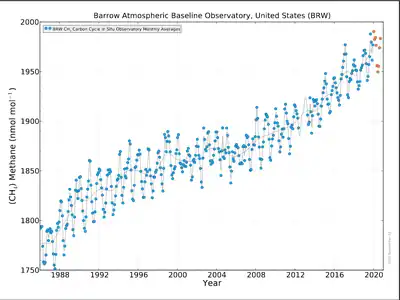
Ce processus se déroule naturellement sur des échelles de temps longues, mais il est probable que le changement climatique de la fin du XXe siècle et du début du XXIe siècle accentue le phénomène. Le méthane étant un gaz à effet de serre, son relargage accéléré entraîne une rétroaction positive sur le réchauffement climatique, c'est-à-dire une accélération de celui-ci.
Spécificités de l'arctique

AIRS 2011 Taux (moyenne annuelle) de méthane dans la haute troposphère (à une pression moyenne de 359 hpa)[2].
La région arctique et certaines zones sub-arctiques[3] diffèrent beaucoup de leurs homologues antarctiques de l'hémisphère sud. L'arctique est l'une des nombreuses sources actuelles de méthane[4].
Les variations futures des émissions arctiques de méthane sont incertaines, mais il existe un consensus sur leur probable augmentation, qui ajoutera ce méthane à celui d'autres sources (fossiles, marines, agricoles, issu des déchets, etc.) du fait de la démographie mondiale, de l’industrialisation de certains pays et de la demande croissante en énergie, ainsi que du réchauffement climatique.
Mais selon certaines sources en contradiction apparente avec ces « prévisions » la concentration mondiale en CH4 semble s'être stabilisée.
Cas de la zone thermokarstique
Cette zone forme une sorte de vaste écotone correspondant à la ligne de fonte du sol gelé. Le pergélisol et les hydrates de méthane se détériorent avec la chaleur. Ils peuvent alors libérer de grandes quantités de méthane, sous l'effet de sources locales de chaleur interne (d'origine volcanique) ou du réchauffement climatique global [5] - [6]. D'autres sources de méthane existent, notamment les taliks sous-marins, le cours de rivières, le retrait des glaces, le pergélisol sous-marin et la décomposition de gisements d'hydrates de gaz[7].
Le réchauffement climatique amplifie le relargage de CH4 à partir des thermokarsts, pour au moins deux raisons :
- d'une part à cause de la libération du méthane contenu dans divers lieux de stockage (clathrates, bulles de gaz piégées dans des poches du sol...)[8] ;
- d'autre part en raison de la méthanogenèse active en été dans la biomasse en décomposition[9]. En Arctique, de larges quantités de méthane sont stockées dans des gisements de gaz naturel, dans le pergélisol ainsi que dans des hydrates de méthane sous-marins.
Cas des zones végétalisées (toundra) et arborées (taïga)
La végétalisation du sol (en particulier quand il s'agit de plantes vasculaires de la toundra humide arctique) peut interférer de plusieurs manières (encore mal quantifiées et comprises), avec les émissions de méthane de l'écosystème[10] :
- par leurs racines ; celles-ci en croissant décolmatent le sol et favorisent la pénétration d'autres organismes (bactéries, champignons, microfaune du sol...), ce qui semblent aussi pouvoir faciliter la remontée de méthane, mais aussi la pénétration de bactéries méthanotrophes (bactéries consommant du méthane) ;
- par diffusion gazeuse de CH4 via les plantes ou certaines plantes (carex notamment) ; du méthane pourrait être absorbé par les racines, puis transporté par la sève jusqu'au stomates qui peuvent le relarguer dans l'air[11].
- par modification de l'albédo, de la température au sol, de la température globale (microclimat) et de l'intensité lumineuse apportée au sol ou aux algues et plantes aquatiques.
Une expérience a, de 1998 à 2000, dans une taïga du Nord-Est du Groenland manipulé l'ombrage au sol durant trois saisons de croissance consécutives des arbres. Les chercheurs ont ainsi pu fortement ralentir le cycle du carbone dans l'écosystème en modifiant aussi la nature de certains échanges avec l'atmosphère (dont pour le CH4). Dans ce cas, la biomasse aérienne totale était corrélée à la moyenne saisonnière des émissions de CH4, avec un potentiel de production de CH4 qui a culminé à la profondeur où la densité racinaire était maximale (5–15 cm). Les chercheurs ont aussi constaté que la qualité du substrat diminuait avec par la baisse des échanges dans les placettes artificiellement ombragées. La concentration de CH4 dissous chutait dans les parcelles témoins en saison de croissance alors qu'elle restait relativement stable dans les placettes artificiellement ombragées, ce qui suggère que l'activité du système racinaire en développement joue un rôle dans la capacité de transport du CH4 du sol vers l'atmosphère. Les auteurs ont conclu que le taux de photosynthèse des plantes vasculaires et l'attribution induite de carbone récemment fixé dans les parties souterraines du sol semblent influencer à la fois le transport du CH4 par les végétaux et la qualité du substrat.
Dans la Toundra ou pré-toundra de la chaîne de Brooks en Alaska (zone où la flore est plus rase), une autre étude a au contraire conclu à une importance apparemment négligeable de la flore, de l'éclairage ou de la photosynthèse, et là, le sol ne relarguait que peu de méthane (20 à 30 fois moins qu'attendus selon la littérature), pour des raisons encore mal comprises[12].
Remarque : d'autres études ont montré que le Castor en tant qu'espèce-ingénieur entretien des boisements plus ensoleillés auprès des cours d'eau et des étangs qu'il crée, et que de nombreuses tourbières périarctiques n'existeraient pas sans lui (or ces tourbières sont aussi des puits de carbone).
Une autre étude a porté (les étés 1995 et 1996) sur l'influence de plusieurs types de flore rivulaire d'un lac glaciaire. Ses résultats évoquent une importance particulière des carex[13], qui faciliteraient la remontée de méthane du sol vers l'atmosphère. Les auteurs ont aussi inséré dans le sol des tubes de caoutchouc de silicone perméable aux gaz, qui semblent être des analogues raisonnables pour décrire le processus physique de « diffusion gazeuse à travers les plantes »[14].
Cas des inlandsis
En 2018, les inlandsis sont encore indûment ignorés dans les « budgets » mondiaux du méthane[15] - [16].
La vie microbienne, presque absente sur et dans la glace est au contraire intense sous la glace polaire arctique au contact des anciens sols organiques, chaque été, quand l'eau liquide est là abondante et circulante (des taux de 106–107 cellules bactériennes par mL d'eau ou de sédiment y sont courants[17] ; l'inlandsis arctique repose en effet en partie sur une invisible mais vaste zone humide encore riche en matière organique, issue d'anciennes toundra et tourbières qui prospéraient là durant les interglaciaires précédents).
Le cycle du méthane y est encore actif[18] mais la quantité totale ou annuelle de méthane relarguable en situation de réchauffement n'est pas encore évaluée.
Des indices (paléo-climatiques notamment[19]) laissent penser que ce CH4 pourrait cependant amplifier le réchauffement climatique[17] - [20].
Les analyses isotopiques montrent que le méthane trouvé dans les eaux de fonte de cette région est bien d'origine microbienne. Une étude récente (2019) a conclu que la matière organique sous-glaciaire du Groenland pourrait avoir une masse et une interface avec l'eau de fonte suffisantes pour influencer les cycles biogéochimiques planétaires. Les scientifiques appellent à évaluer le métabolisme estival des microbes sous-glaciaires de l'arctique, et à étudier le bilan émission/puits des écosystèmes sous-glaciaires polaires, car chaque été, en situation anoxique des bactéries y décomposent la matière organique en libérant du CO2 et du CH4. Mais d'autre part, en périphérie du bassin (vers les exutoires d'eau de fonte), l'écosystème microbien sous-glaciaire est plus oxygéné et abrite là une grande quantité de bactéries métanotrophes (qui « consomment » du méthane).
Les étés 2012 et 2013 des chercheurs ont commencé à étudier la biogéochimie des écosystèmes microbiens situés sous le glacier Russel (bordure ouest du Groenland), via les eaux de fontes drainées sous le glacier : là le méthane se montre essentiellement produit par des bactéries (Methanosarcinales et Methanomicrobiales). Mais en périphérie, la biomasse sous-glaciaire la plus active et abondante s'avère être composée de bactéries méthanotrophes de l’ordre des méthylococcales qui constituent, elles, au contraire un "puits de méthane". Durant les 2 étés 2012 et 2013, sous ce glacier Russel, le méthane dissous retrouvé dans l'eau de fonte drainée sous le glacier variait de 2,7 à 83 µm ; et sa concentration était toujours inversement corrélée à celle de l'oxygène dissous ; elle était par contre positivement corrélé à la conductivité électrique de l'eau. En conditions aérobie, plus de 98 % du méthane de l'eau sous-glaciaire échantillonnée était consommé en environ 30 jours d'incubation à ±4 °C et (taux d'oxydation microbienne[21] du méthane estimés à 0,32 µm/24h) avec alors des émissions de CO2, mais moins « à effet de serre » que celles de CH4.
À chaque saison de fonte des glaces, se forment sous l'indlandsis des réseaux de ruisseaux, de torrents, tunnels, lacs, etc. Apparaissent alors en périphérie de l'indlansis des "bouffées" d'eaux sursaturées en méthane (CH4 (aq)). Ces eaux drainées sous la calotte glaciaire jusqu'à sa périphérie laissent alors rapidement une partie de leur méthane s'échapper dans l'air[22] (l'« évasion atmosphérique » est dans cette région le principal puits de méthane une fois que le ruissellement atteint la bordure de la calotte de glace) . Pour la zone étudiée, la première estimation de ce flux saisonnier était de 6,3 tonnes (moyenne ; allant de 2,4 à 11 tonnes) de CH4 dissous (CH4aq) transporté latéralement depuis le dessous de la calotte glaciaire.
L'hydrologie sous-glaciaire est moins connue sous une grande partie de l'arctique que sous certains glaciers alpins[23] ou dans certains contextes paléoclimatologiques européens[24]. Elle apparait en arctique être un facteur crucial dans le « contrôle » des flux de méthane de la calotte glaciaire. En effet, lors du drainage des eaux saturées en méthane, seul 17 % de ce méthane exporté est oxydé, le reste passant dans l'air[25]. En arctique, les flux de diffusion de méthane sous-glaciaire (4,4 à 28 millimoles ou CH4 par mètre carré et par jour), rivalisent donc avec les émissions des grands fleuves mondiaux (elles-aussi longtemps sous-estimées et pour cette raison non-prises en compte dans les bilans globaux)[26].
Paléoclimatologie, vagues d'extinction et paléoécologie des interglaciaires
On constate que plus le climat se réchauffe, aujourd'hui et lors des interglaciaires précédents, plus l'asymétrie des taux de méthane augmente entre les deux pôles. Pendant les périodes interglaciaires précédentes, les concentrations de méthane dans l'atmosphère terrestre étaient environ deux fois plus élevées que les valeurs les plus faibles relevées au cours d'un âge glaciaire.
Les concentrations dans l'atmosphère arctique sont 8 à 10 % plus élevées que dans l'atmosphère de l'Antarctique.
Au cours des périodes glaciaires, ce gradient entre l'Arctique et l'Antarctique s'était réduit pour atteindre un niveau négligeable[27].
Les écosystèmes terrestres sont considérés comme la principale source d’asymétrie, même s'il a été souligné que le rôle de l'océan Arctique est largement sous-estimé[28]. Il a été démontré que la température du sol et le niveau d'humidité avaient un impact important sur les échanges de méthane dans la toundra[29] - [30].
Notes et références
- NOAA/Observatoire de Point Barrow, Alaska, 71.323 -156.611.
- « Giovanni », sur Giovanni (en), NASA (consulté le ).
- Christensen, T. R., Johansson, T., Åkerman, H. J., Mastepanov, M., Malmer, N., Friborg, T., ... & Svensson, B. H. (2004). Thawing sub‐arctic permafrost: Effects on vegetation and methane emissions. Geophysical Research Letters, 31(4).
- (en) A. A. Bloom, P. I. Palmer, A. Fraser, D. S. Reay et C. Frankenberg, « Large-Scale Controls of Methanogenesis Inferred from Methane and Gravity Spaceborne Data », Science, American Association for the Advancement of Science (AAAS), vol. 327, no 5963, , p. 322-325 (ISSN 0036-8075, DOI 10.1126/science.1175176, lire en ligne).
- (en) Zimov, Sa; Schuur, Ea; Chapin, Fs, 3Rd, « Climate change. Permafrost and the global carbon budget. », Science, vol. 312, no 5780, , p. 1612–3 (ISSN 0036-8075, PMID 16778046, DOI 10.1126/science.1128908)
- (en) Shakhova, Natalia, « The distribution of methane on the Siberian Arctic shelves: Implications for the marine methane cycle », Geophysical Research Letters, vol. 32, no 9, , p. L09601 (DOI 10.1029/2005GL022751, Bibcode 2005GeoRL..3209601S)
- (en)Natalia Shakhova et Igor Semiletov, « Methane release and coastal environment in the East Siberian Arctic shelf », Journal of Marine Systems, vol. 66, nos 1–4, , p. 227–243 (DOI 10.1016/j.jmarsys.2006.06.006, Bibcode 2007JMS....66..227S)
- (en) Merritt R. Turetsky, Benjamin W. Abbott, Miriam C. Jones et Katey Walter Anthony, « Carbon release through abrupt permafrost thaw », Nature Geoscience, vol. 13, no 2, , p. 138–143 (ISSN 1752-0908, DOI 10.1038/s41561-019-0526-0, lire en ligne, consulté le )
- (en) K. M. Walter, J. P. Chanton, F. S. Chapin, E. A. G. Schuur et S. A. Zimov, « Methane production and bubble emissions from arctic lakes: Isotopic implications for source pathways and ages », Journal of Geophysical Research, Wiley-Blackwell, vol. 113, (ISSN 0148-0227, DOI 10.1029/2007JG000569, lire en ligne)
- Joabsson A & Christensen T R (2001) Methane emissions from wetlands and their relationship with vascular plants : an Arctic example. Global Change Biology, 7(8), 919-932.résumé
- Morrissey, L. A., D. B. Zobel, G. P. Livingston, Significance of stomatal control on methane release from Carex-dominated wetlands, Chemosphere, 26, 1–4339, 1993.
- Torn MS & Chapin III FS (1993) Environmental and biotic controls over methane flux from arctic tundra. Chemosphere, 26(1), 357-368. (résumé ScienceDirect)
- Kelker D & Chanton J, The effect of clipping on methane emissions from Carex, Biogeochemistry, 39, 37–44, 1997
- (résumé)
- Kirschke, S. et al. (2013) Three decades of global methane sources and sinks. Nat. Geosci. 6, 813–823 |url+https://pdfs.semanticscholar.org/5c95/55488862df46651f3e97a9cbbcb0bc0cdabf.pdf
- Schaefer H et al. (2016) A 21st century shift from fossil-fuel to biogenic methane emissions indicated by 13CH4. Science 352, 80–84 (résumé)
- Wadham J.L, Tranter M, Tulaczyk S & Sharp M (2008) Subglacial methanogenesis: a potential climatic amplifier? Global Biogeochem. Cy. 22, GB2021| URL=https://agupubs.onlinelibrary.wiley.com/doi/full/10.1029/2007GB002951
- Broemsen E.L (2014) Evidence of methane cycling beneath the western margin of the Greenland Ice Sheet
- Petrenko V.V & al. (2017) Minimal geological methane emissions during the Younger Dryas–Preboreal abrupt warming event. Nature 548, 443–446 |URL=https://www.nature.com/articles/nature23316
- Wadham J.L et al. (2012) Potential methane reservoirs beneath Antarctica. Nature 488, 633–637.
- Michaud A.B & al. (2017) Microbial oxidation as a methane sink beneath the West Antarctic Ice Sheet. Nat. Geosci. 10, 582–586.
- Maurice L, Rawlins B.G, Farr G, Bell R & Gooddy D.C (2017) The influence of flow and bed slope on gas transfer in steep streams and their implications for evasion of CO2. J. Geophys. Res. Biogeosci. 122, 2862–2875.
- Hubbard, B., & Nienow, P. (1997). Alpine subglacial hydrology. Quaternary Science Reviews, 16(9), 939-955.
- Piotrowski J.A (1997) Subglacial hydrology in north-western Germany during the last glaciation: groundwater flow, tunnel valleys and hydrological cycles. Quaternary Science Reviews, 16(2), 169-185.
- Dieser, M. et al. (2014). Molecular and biogeochemical evidence for methane cycling beneath the western margin of the Greenland Ice Sheet. ISME J. 8, 2305–2316
- Stanley E.H & al. (2016) The ecology of methane in streams and rivers: patterns, controls, and global significance. Ecol. Monogr. 86, 146–171
- (en) Climate Change 2001: The Scientific Basis, GIEC, Cambridge Univ. Press, Cambridge, 2001.
- (en) N. E. Shakhova, I. P. Semiletov, A. N. Salyuk, N. N. Bel’cheva, and D. A. Kosmach,, « Methane Anomalies in the Near-Water Atmospheric Layer above the Shelf of East Siberian Arctic Shelf », Doklady Earth Sciences, vol. 415, no 5, , p. 764–768 (DOI 10.1134/S1028334X07050236, Bibcode 2007DokES.415..764S)
- (en) Margaret Susan Torn et F. Stuart Chapin, « Environmental and biotic controls over methane flux from Arctic tundra », Chemosphere, Elsevier BV, vol. 26, nos 1-4, , p. 357-368 (ISSN 0045-6535, DOI 10.1016/0045-6535(93)90431-4, lire en ligne)
- (en) S. C. Whalen et W. S. Reeburgh, « Consumption of atmospheric methane by tundra soils », Nature, Nature Publishing Group, vol. 346, no 6280, , p. 160-162 (ISSN 0028-0836, DOI 10.1038/346160a0, lire en ligne)
Voir aussi
Bibliographie
- Christensen, T. R. (1993). Methane emission from Arctic tundra. Biogeochemistry, 21(2), 117-139 (résumé)
- Morrissey LA & Livingston GP (1992) Methane emissions from Alaska arctic tundra : An assessment of local spatial variability. Journal of Geophysical Research: Atmospheres (1984–2012), 97(D15), 16661-16670 (résumé).
- Schimel, J. P. (1995). Plant transport and methane production as controls on methane flux from arctic wet meadow tundra. Biogeochemistry, 28(3), 183-200 (résumé).
- Shakhova, N., Semiletov, I., Salyuk, A., Yusupov, V., Kosmach, D., & Gustafsson, Ö. (2010). Extensive methane venting to the atmosphere from sediments of the East Siberian Arctic Shelf. Science, 327(5970), 1246-1250.
- Wille C, Kutzbach L, Sachs T, Wagner D & Pfeiffer E (2008). emission from Siberian arctic polygonal tundra: eddy covariance measurements and modeling. Global Change Biology, 14(6), 1395-1408.
Articles connexes
Lien externe
- AMEG’s Declaration (Urgent Message to Governments from the Arctic Methane Emergency Group, AMEG ) Arctic Sea Ice - Methane Release - Planetary Emergency; AMEG (Arctic Methane Emergency Group)
