Purification des protéines
La purification des protéines[1] est une série de processus divers destinés à isoler une ou plusieurs protéines à partir d'un mélange complexe (cellules, autres particules ou matrices). C'est une étape importante en recherche fondamentale pour la caractérisation de la fonction (études des propriétés), de la structure, sa composition en acide aminé et des interactions d'une protéine d'intérêt, mais aussi en recherche appliquée et industrie pour préparer des matières et réactifs.
Les différentes étapes de la purification consistent en des processus successifs de simplification du mélange complexe initial, retrait des déchets cellulaires (membranes, organites), élimination du matériel génétique, élimination ou conservation de certaines protéines en fonction de leurs caractéristiques chimiques (taille, charge électrique, affinité), isolation par affinité spécifique de la protéine d'intérêt. Toutefois il est difficile voir impossible d'obtenir une protéine totalement pure (l'obtention de protéines enrichies est suffisante)[2].
Souvent en fin de purification on réalise une mesure de la pureté de la protéine d'intérêt.
Matériel et étapes préliminaires
On trouve généralement des protéines dans les tissus biologiques ou les cultures cellulaires (eucaryote ou procaryote).
Pour extraire les protéines, plusieurs étapes sont donc nécessaires.
Lyse des cellules
L'étape de lyse consiste à rompre les parois cellulaires et membranes biologiques[3].
Plusieurs méthodes de lyse cellulaire peuvent être utilisées :
- Lyse mécanique : broyage, sonication (vibrations qui détruisent les parois cellulaires)[4], french press (pression), détergents ou autres adjuvants d'extraction (des inhibiteurs de protéases, des antibiotiques, des chélatants… afin de protéger les protéines d'intérêt).
- Lyse enzymatique : choc osmotique, cycles de congélation/décongélation, lyzozyme
Centrifugation
L'étape de centrifugation permet une première séparation grossière des débris cellulaires en suspension (parois, mitochondries...)
Solubilisation
Une étape de solubilisation consiste à rendre les protéines solubles, généralement en phase aqueuse. Ceci est typiquement réalisé par des détergents, comme le SDS, le Triton X-100 ou le Nonidet, ou agents chaotropiques (Urée).
Il est important de préserver la stabilité des protéines (elles ne doivent pas précipiter). Pour cette raison, il faut surveiller l'évolution de facteurs influençant leur solubilité :
Des étapes de fractionnement des protéines s'ensuivent, recourant à différentes méthodes.
Fractionnement par répartition entre phases
L'échantillon est mélangé avec un solvant polaire (solution tampon aqueuse) et un autre apolaire (solvant organique, phenol, chloroforme…) qui ne sont pas miscibles. Les protéines se répartissent entre les différentes phases liquides selon leur solubilité respectives dans chaque solvant. On récupère la phase inférieure et/ou supérieure après décantation.
Fractionnement par précipitation différentielle
Une ou des protéines (d'intérêt, ou au contraire indésirable) sont précipitées en présence de conditions particulières. Ainsi les euglobulines (protéines solubles spéhariques) précipitent en solution aqueuse en présence des sels à partir d'une certaine concentration. Par exemple, les immunoglobulines IgG précipitent en présence de 30-60 % de sulfate d'ammonium. Outre la nature et concentration des sels, la température et le pH entrent en jeu.
Différentes techniques de purification
Purification par déplétion
Il s'agit d'éliminer des composés indésirables, par précipitation, par adsorption, par affinité…
Purification par chromatographie préparative
La chromatographie préparative est utilisée pour séparer et purifier les protéines.
Définition : Méthode physique de séparation basée sur les différences d'affinité de substances à analyser à l'égard de 2 phases, l'une stationnaire ou fixe, l'autre mobile[5].
Etapes d'une chromatographie :
- Equilibration : la solution tampon sans protéines passe au travers de la phase stationnaire.
- Injection : la solution contenant la protéine d'intérêt passe au travers de la phase stationnaire.
- Lavage : différents tampons passent au travers de la phase stationnaire. Ces trois premières phases utilisent des principes communs aux différentes techniques de chromatographie.
- Elution ou décrochage : on libère les protéines d'intérêt fixées sur la phase stationnaire. Cette dernière phase utilise un principe pouvant adopter différentes variations selon la chromatographie utilisée. Ainsi, la spécificité de la phase d'élution sera détaillée pour les différentes techniques présentées ci dessous.
Différents types de chromatographie préparative selon différents mécanismes de rétention sont détaillées ensuite[6] .
Chromatographie à échange d'ions[7]
Principe de la chromatographie échangeuse d'ions:
La chromatographie échangeuse d'ions permet de séparer les composés en fonction de leur charge globale qui varie selon son environnement (c'est-à-dire selon la solution qui l'entoure). Cette séparation est possible grâce une colonne (résine, silice, ...) qui est choisie selon son type et sa force de charge[8].
Le choix de la résine se fait en fonction de la solution tampon et du point isoélectrique (pI) de la protéine. Le pI (aussi nommé pHi, pH isoélectrique) correspond au pH pour lequel la charge de la protéine est nulle.
Il existe 2 types de résines:
- Des résines échangeuses d'anions (ex: Cellulose DiEthylAminoEthyl (DEAE)[8]) qui possèdent une charge positive et qui retiennent alors les composés chargés négativement (anions)[8], c'est lorsque le pH de la solution est supérieur au point isoélectrique de la protéine[9].
- Des résines échangeuses de cations (ex: Cellulose Carbonyl-méthyl) qui possèdent une charge négative et qui retiennent alors les composés chargés positivement (cations)[8], c'est lorsque le pH de la solution est inférieur au point isoélectrique de la protéine[9].
Une solution tampon est versée sur la colonne avant la séparation pour équilibrer les ions chargés.
La durée de rétention de chaque soluté dépend de la force de sa charge[10]. En effet, les composés les plus faibles seront élués en premier, ensuite viendront ceux qui sont chargés plus fortement. Mais le pH, le tampon et la température utilisés varient le contrôle de la séparation.
Elution/Décrochage :
Pour éluer/décrocher les protéines fixés sur la résine, on peut:
- Soit on peut faire un gradient de la force ionique: Pour cela, on utilise une solution tampon enrichie en sels (souvent NaCl) pour augmenter la concentration en sels.
- Soit on peut faire varier le pH (en fonction de la charge et du pI de la protéine d'intérêt).
Chromatographie d'affinité[11]
La chromatographie d'affinité est une technique de séparation des molécules tenant compte de leur conformation respective, utilisant des résines spécifiques. Ces résines ont des ligands attachés sur leurs surfaces qui sont spécifiques des composés qui doivent être séparés. Le plus fréquemment, la fonction de ces ligands est similaire aux interactions antigène-anticorps. Ce système clé serrure entre le ligand et son composé cible est hautement spécifique, ce qui fait que les autres molécules ne s'accrochent pas à la résine.
On peut utiliser cette chromatographie pour purifier des protéines avec une immuno-affinité ou des protéines liées avec des étiquettes.
Elution/Décrochage[12] : libérer les protéines d'intérêt puis faire passer une solution contenant des ligands : les protéines se fixent préférentiellement sur ces ligands en solution, il y a alors une libération.
Chromatographie par filtration sur gel
Une technique de chromatographie par exclusion stérique :
La chromatographie par filtration sur gel a pour but la dissociation des molécules en fonction de leur taille et de leur forme.
Souvent, on utilise cette technique pour le fractionnement des mélanges d’origine biologique qui sont, dans la plupart des cas, très sensibles à la dénaturation.
L'expérience se déroule comme suit : les premières à être éluées, au niveau du volume mort, sont les grosses molécules dont le diamètre est plus grand que celui des pores. Ensuite les petites et moyennes molécules sont éluées du fait qu’elles sont incluses dans le gel ce qui va entraîner le freinage de leur migration[13].
La chromatographie par filtration sur gel permet de déterminer la masse moléculaire d’une protéine. Il existe en effet une relation linéaire entre le logarithme décimal de la masse moléculaire d’une molécule et son rapport Ve/V0. Ve correspond au volume d’élution de la molécule et V0 au volume d’exclusion du gel, c’est-à-dire au volume d’élution d’une molécule non retardée. On utilise généralement le bleu Dextran pour déterminer ce volume d’exclusion.
La première étape est de séparer par chromatographie un mélange de molécules dont on connaît la masse moléculaire. On peut alors tracer une droite étalon d’équation Ve/V0 = f[log10(masse moléculaire)]. On détermine ensuite le volume d’élution de la protéine dont on veut déterminer la masse moléculaire en réalisant une chromatographie dans les mêmes conditions que la précédente. On peut alors remonter à sa masse moléculaire grâce à la droite étalon[14].
Chromatographie d'interaction hydrophobe[15]
La chromatographie d'interaction hydrophobe sépare les protéines en fonction de leur caractère hydrophobe. Son principe repose sur le fait qu'en présence d'une force ionique élevée (fortes concentrations en sels), les molécules d'eau constituant l'enveloppe d'hydratation des protéines sont déplacées pour hydrater les anions et les cations provenant de la dissociation du sel (relargage, salting out). Ceci entraine une réorganisation des molécules d'eau autour des protéines et l'exposition de leurs zones hydrophobes favorisant l'établissement d'interactions hydrophobes entre ces zones (normalement enfouies) et les groupements hydrophobes portés par la phase stationnaire. Les protéines qui se lient à la phase stationnaire réadoptent leur conformation native lorsqu'un tampon avec une force ionique faible est ajouté. Il en résulte une élution des protéines. Le gel de chromatographie d'interaction hydrophobe porte un groupement hydrophobe comme un noyau phénol à l'extrémité d'une chaîne carbonée. Ce groupe hydrophobe interagit avec les zones hydrophobes situées à la surface des protéines. La chromatographie d'interaction hydrophobe peut être une méthode de séparation précieuse pour la purification des protéines qui peuvent se replier spontanément par une diminution de la force ionique. Cependant, sous crainte de précipitation par les sels d'une protéine d'intérêt, la force ionique du tampon de liaison doit être aussi faible que possible pour lier la protéine, tout en empêchant sa précipitation. Pour éviter le risque de précipitation, une force ionique plus faible peut être utilisée. Dans le cas contraire, il faut faire fixer les protéines contaminantes et récupérer la protéine d'intérêt dans la fraction non retenue[16].
1ère étape : On fixe la protéine à séparer sur le support chromatographique en présence d'une forte concentration en sel :
- dans un milieu à haute force ionique, les molécules d'eau de l'enveloppe d'hydratation des protéines sont "mobilisées" pour hydrater les anions et les cations issus de la dissociation du sel, c'est le phénomène de "salting -out".
- il en résulte une modification de l'organisation des molécules d'eau autour des protéines et ce changement d'environnement est favorable (comme cela est défini ci-dessus) à l'établissement d'interactions hydrophobes entre les régions hydrophobes à la surface des protéines et le groupement hydrophobe porté par la phase stationnaire.
2ème étape : Après rinçage du gel afin d'éliminer les protéines non adsorbées, l'élution des protéines fixées est obtenue :
- en faisant passer un tampon de force ionique décroissante, les ions du sel étant ainsi progressivement éliminés.
- les acides aminés chargés ou polaires à la surface des protéines peuvent de nouveau établir des liaisons hydrogène avec la phase mobile, c'est-à-dire que la solubilité des protéines dans la phase mobile redevient maximale et elles sont éluées.
Il existe d'autres moyens d'éluer les protéines fixées :
- ajouter un ion aux propriétés chaotropiques qui induit une diminution de l'organisation des molécules d'eau (donc une augmentation de leur entropie) : la force des interactions hydrophobes est ainsi diminuée.
- ajouter un détergent / augmenter le pH / diminuer la température puisque la force des interactions hydrophobes diminue avec celle -ci[17].
Purification par électrophorèse séparative
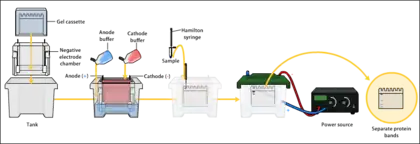
L'électrophorèse est une méthode physique de séparation basée sur la migration des protéines dans un champ électrique. Une solution de protéine dissoute dans une solution tampon est déposée sur un support (gel de polymères). Un champ électrique est appliqué, ainsi les molécules anioniques (chargées négativement) migrent vers la borne (+) et les molécules cationiques (chargées positivement) migrent vers la borne (-).
Les techniques d'électrophorèse sont peu utilisées pour : la purification quantitative des protéines et le contrôle qualité des fractions protéiques (plus courant).
Les principales méthodes d'électrophorèse séparative utilisées pour séparer et purifier les protéines sont les suivantes :
- électrophorèse capillaire[18] : il s'agit d'une méthode utilisée pour analyser des composés lorsqu'ils se trouvent en phase liquide. C’est une technique effectuée au sein d’un capillaire rempli d’un électrolyte de séparation. Ce capillaire fait quelques dizaines de micromètres de diamètre et est soumis à un champ électrique[19].
- électrophorèse en gel d'agarose [20] : séparation des acides nucléiques chargés négativement à travers la matrice du gel d'agarose sous l'effet d'un champ électrique.
- électrophorèse sur gel de polyacrylamide [21] : en condition non dénaturante, il faut faire le gel et faire passer le courant. Ce dernier passe alors par une borne puis traverse le gel et va à l'autre borne.
- électrophorèse sur gel de polyacrylamide en présence de dodécylsulfate de sodium : aussi appelée électrophorèse SDS-PAGE. Le SDS est un détergent qui donne une charge négative aux protéines. Ainsi, le seul facteur de séparation des protéines est le poids moléculaire puisque toutes les protéines migreront vers l'anode[22].
- focalisation isoélectrique : séparation des protéines en fonction de leur point isoélectrique (= pH pour lequel les protéines ont une charge globale neutre) grâce à un gradient de pH établi dans un gel[23].
Références
- (en) Jeremy M. Berg, John L. Tymoczko et Lubert Stryer, « The Purification of Proteins Is an Essential First Step in Understanding Their Function », Biochemistry. 5th edition, (lire en ligne, consulté le )
- « Biochimie des protéines BCM514 », sur biochimiedesproteines.espaceweb.usherbrooke.ca (consulté le )
- « Etude de l’extraction des protéines de coproduitsd’abattage et de leur valorisation comme ingrédientsfonctionnels »
- « Sonification : Définition simple et facile du dictionnaire », sur www.linternaute.fr (consulté le )
- Julie Brouchon, Chromatographie cellulaire d’affinité : étudeexpérimentale des mécanismes de capture spécifique etimplications pour un développement industriel (thèse de doctorat de Physico-Chimie
Université Pierre et Marie Curie
Ecole doctorale Chimie Physique et Chimie Analytique de Paris
Centre Laboratoire Colloïdes et Matériaux Divisés), , 150 p. (lire en ligne), p. 28 :
« "Une technique largement utilisée enchimie analytique, en particulier à l’échelle industrielle, est la chromatographie : la séparation de composés en fonction de leurs affinités pour la phase mobile dans laquelle ils sont dissouts et une phase stationnaire dans laquelle ils s’écoulent." »
- Alain Lavoinne (Auteur), Soumeya Bekri (Auteur), Pierre Kamoun (Préface), Aide-mémoire de biochimie et biologie moléculaire, Médecine Sciences - Flammarion, 6e édition, 2008
- Philip M. Cummins, Keith D. Rochfort et Brendan F. O'Connor, « Ion-Exchange Chromatography: Basic Principles and Application », Methods in Molecular Biology (Clifton, N.J.), vol. 1485, , p. 209–223 (ISSN 1940-6029, PMID 27730555, DOI 10.1007/978-1-4939-6412-3_11, lire en ligne, consulté le )
- « 123bio.net - Chromatographie : introduction », sur www.123bio.net (consulté le )
- « Kits et colonnes pour la chromatographie échangeuse d'ions Clinisciences », sur www.clinisciences.com (consulté le )
- « Les résines échangeuses d'ions », sur processs.free.fr (consulté le )
- (en) David S. Hage, « Analysis of Biological Interactions by Affinity Chromatography: Clinical and Pharmaceutical Applications », Clinical Chemistry, vol. 63, no 6, , p. 1083–1093 (ISSN 0009-9147 et 1530-8561, PMID 28396561, DOI 10.1373/clinchem.2016.262253, lire en ligne, consulté le )
- Marjeta Urh, Dan Simpson et Kate Zhao, « Affinity chromatography: general methods », Methods in Enzymology, vol. 463, , p. 417–438 (ISSN 1557-7988, PMID 19892186, DOI 10.1016/S0076-6879(09)63026-3, lire en ligne, consulté le )
- « 123bio.net - Chromatographie : introduction », sur www.123bio.net (consulté le )
- « Chromatographie echange ion gel filtration tamis moleculaire methodologie TP biochimie Enseignement et recherche Biochimie - Universite Angers Emmanuel Jaspard biochimej », sur biochimej.univ-angers.fr (consulté le )
- (en) Brendan F. O’Connor et Philip M. Cummins, « Hydrophobic Interaction Chromatography », dans Protein Chromatography: Methods and Protocols, Springer New York, coll. « Methods in Molecular Biology », (ISBN 978-1-4939-6412-3, DOI 10.1007/978-1-4939-6412-3_18, lire en ligne), p. 355–363
- « Chromatographie d'interactions hydrophobes hydrophobic interaction chromatography, كروماتوغرافياالتفاعل الهيدروفوبي »
- « Chromatographie liquide liquid chromatography HPLC Enseignement et recherche Biochimie Emmanuel Jaspard Universite Angers biochimej », sur biochimej.univ-angers.fr (consulté le )
- Mais Olabi, Matthias Stein et Hermann Wätzig, « Affinity capillary electrophoresis for studying interactions in life sciences », Methods (San Diego, Calif.), vol. 146, 08 15, 2018, p. 76–92 (ISSN 1095-9130, PMID 29753786, DOI 10.1016/j.ymeth.2018.05.006, lire en ligne, consulté le )
- Nathalie DELAUNAY, « Électrophorèse capillaire - Principes », sur Ref : TIP630WEB - "Techniques d'analyse", (consulté le )
- D. Voytas, « Agarose gel electrophoresis », Current Protocols in Molecular Biology, vol. Chapter 2, , Unit2.5A (ISSN 1934-3647, PMID 18265185, DOI 10.1002/0471142727.mb0205as51, lire en ligne, consulté le )
- Julie L. Brunelle et Rachel Green, « One-dimensional SDS-polyacrylamide gel electrophoresis (1D SDS-PAGE) », Methods in Enzymology, vol. 541, , p. 151–159 (ISSN 1557-7988, PMID 24674069, DOI 10.1016/B978-0-12-420119-4.00012-4, lire en ligne, consulté le )
- « Electrophorèse SDS PAGE : principe et exemple d'application en STL Biotechnologies - Les séries SMS, BSE et BGB », sur sms-bse-bgb.discip.ac-caen.fr (consulté le )
- CISMeF, « CISMeF », sur www.chu-rouen.fr (consulté le )