Focalisation isoélectrique
La focalisation isoélectrique (IEF de l'anglais isoelectric focusing ou electrofocusing) est une technique de séparation des molécules, tel que les protéines, par des différences dans leur point isoélectrique. C'est un type d'électrophorèse de zone.
Elle a des applications autant préparatoires qu’analytiques. Elle est principalement utilisée dans le domaine de la biochimie. Elle sert essentiellement à séparer les protéines les unes des autres en fonction de leur point isoélectrique unique[1].
Bien que les chercheurs Ikeda et Suzukion furent les premiers à remarquer que les acides aminés séparés d’une protéine formaient un gradient de pH lorsque placés entre deux électrodes, c’est au biophysicien russe Alexander Kolin que l’on attribue la plus grande contribution au développement de la focalisation isoélectrique. C’est en se basant sur les notions déjà appliquées à l’électrophorèse à son époque que l’ancien professeur de l’Université de Californie à Los Angeles a développé la focalisation isoélectrique en 1954[1]. Cette technique est si étroitement liée à l’électrophorèse qu’on l’appelle aussi électrophorèse isoélectrique[2].
De plus, bien que l’exécution de cette technique était plutôt longue et fastidieuse à ses balbutiements dans le milieu des années cinquante[3], la focalisation isoélectrique est aujourd’hui l’une des techniques les plus utilisées pour la séparation et la caractérisation des protéines d’un mélange. En effet, grâce à son pouvoir de résolution inégalé et à sa compatibilité avec un large éventail de méthodes de séparations, l’électrofocalisation est présentement une méthode indispensable à quiconque entreprenant l’étude des protéines[1].
Principe de base
Le point isoélectrique
Les séparations par IEF sont basées sur les propriétés de charge des molécules. Comme il a été mentionné lors de l’introduction, il s’agit plus particulièrement du point isoélectrique unique de chaque molécule qui est utilisé afin de les séparer et de les purifier à partir d’un mélange. En fait, le point isoélectrique se définit comme étant le pH spécifique où une molécule ne possède aucune charge électrique nette. C’est donc pour cette raison que l’IEF s’applique spécifiquement à la séparation de molécules amphotères qui peuvent agir à la fois comme un acide ou une base[1]. Les acides aminés formant les protéines étant des zwitterions, soient « des espèces ioniques qui portent simultanément une charge positive et une charge négative »[4], c’est pour cette raison que la focalisation isoélectrique est particulièrement utilisée afin de procéder à la séparation des espèces protéiques d’un mélange.
L'introduction d'un courant électrique
Lors de la focalisation isoélectrique, c’est par l’introduction d’un courant électrique que la migration des espèces chargées est induite. En effet, une différence de potentiel est appliquée entre une anode et une cathode afin de faire migrer les molécules chargées positivement vers la cathode et celles chargées négativement vers l'anode. Par contre, la séparation des molécules protéiques d’intérêt ne peut être atteinte en l’absence d’un gradient de pH[2].
Le gradient de pH
À un pH donné, soit à l’atteinte du point isoélectrique, les protéines se retrouvent nécessairement sans charge nette, celles-ci arrêtent de migrer sous l’effet du champ électrique induit. Alors, les protéines possédant toutes un point isoélectrique différent, celles-ci se concentrent dans une zone bien définie où le pH du gradient est égal à leur point isoélectrique. C’est donc la combinaison du gradient de pH avec le passage d’un courant électrique à travers l’analyte qui permet vraiment la séparation des polypeptides de ce dernier[1].
Le gradient de pH étant un paramètre clé de la focalisation isoélectrique, sa nature détermine largement la qualité de la séparation. Les deux principales façons d’obtenir un gradient de pH sont les suivantes[1]:
Capillaire
Le gradient de pH est généré à l’aide d’une solution tampon de plusieurs ampholytes ayant un point isoélectrique différent soumise à un courant électrique. Il est à noter que « les ampholytes sont des composés amphotères qui contiennent habituellement des groupements acide carboxylique et amine »[2]. Il est d’ailleurs possible de préparer en laboratoire ces solutions aqueuses d’ampholytes couvrant des gammes de pH différents selon les molécules à séparer ou de se les procurer commercialement.
Avec cette technique, les analytes sont dissous dans une solution d’ampholytes dans un tube capillaire placé entre une cathode, où se trouve un électrolyte basique, et une anode, où se trouve un électrolyte acide. Une fois la tension constante appliquée aux bornes des électrodes, les cations, les anions et les différents ampholytes migrent d’un côté ou de l’autre de la cellule d’électrophorèse, les plus acides à l’anode et les plus basiques à la cathode, créant ainsi un gradient de pH dans lequel les analytes peuvent migrer, jusqu’à ce qu’ils atteignent une zone de pH où leur charge nette est nulle. Les différents analytes, habituellement de nature peptidique, arrêtent alors de migrer, puisque leur charge nette est de zéro, et ils sont alors séparés en fonction de leur point isoélectrique[2].
Cette méthode par capillaire permet d’utiliser un plus grand champ électrique puisque l’étroitesse du capillaire permet une diminution de la température plus rapidement. Un plus grand champ électrique permet de diminuer le temps de séparation de quelques minutes. Cette technique diminue également l’étalement des bandes par diffusion, ce qui les rendent plus nettes. Cependant, elle permet seulement de séparer une petite quantité de molécules. L’électrophorèse en capillaire a une bonne résolution et peut être automatisée, un peu comme la chromatographie en phase liquide à haute performance. Elle permet l’analyse d’une plus grande quantité de molécules, on peut analyser des protéines, des acides nucléiques, des peptides, des glucides, des cations, des anions, des vitamines, des pesticides des virus et même des cellules entières[5].
Sur gel
Le gradient de pH mobile est généré dans le gel de polyacrylamide par les ampholytes liés aux unités d’acrylamides de façon à créer un gradient de pH d’un bout à l’autre du gel lors du passage d’un courant électrique. Il s’agit d’un gel synthétique qui peut être acheté commercialement[5].
Ce gel est préparé en utilisant des ampholytes, qui sont porteurs de charges et tout comme les protéines, possèdent des points isoélectriques différents. On doit soumettre un courant électrique aux ampholytes afin d’obtenir un gradient de pH qui augmente vers la cathode. Par la suite, la charge nette pour les ampholytes sera nulle, donc les molécules ne bougeront plus et on aura un gradient de pH immobile. Cette technique de la formation du gradient de pH permet d’obtenir un gradient qui est stable pour la séparation de molécules par focalisation isoélectrique[6].
Les ampholytes peuvent être également liés à l’acrylamide polymérisé afin de créer un gel avec gradient à pI immobilisé. Ce type de gel permet d’éviter un problème qui peut être présent lorsque l’on utilise la focalisation isoélectrique, soit la dérivation cathodique, où le gradient de pH va se désintégrer avec le temps. Cette méthode pour la formation du gradient permet donc une plus grande reproductibilité et permet l’analyse d’un plus grand nombre de molécules en même temps puisque le gradient de pI est plus stable. Un second phénomène qui peut changer le gradient de pH et la résolution est l’électroosmose. Cela est observé lorsque la matrice ou une partie de l’équipement qui sont en contact directe avec le gel portent une charge[6].
Avec cette méthode sur gel, l’échantillon liquide contenant les analytes peut être introduit à n’importe quel endroit sur le gel de polyacrylamide et les protéines migreront spontanément vers l’anode ou la cathode jusqu’à l’atteinte de leur point isoélectrique, en présence d’un courant électrique. Comme pour la technique précédente, les protéines seront alors séparées selon leur point isoélectrique[5].
Il est à noter que c’est le gel de polyacrilamide qui est le plus souvent utilisé de nos jours et que la focalisation isoélectrique est souvent couplée à l’électrophorèse sur gel 2D qui permet une meilleure séparation en fonction du poids de la molécule[1].
Mobilisation
Une fois les protéines séparées en bandes lors de l’IEF, il est nécessaire de faire la détection des différentes protéines séparées afin d’en faire l’analyse. Pour ce faire, deux techniques sont utilisées afin de mener les protéines au détecteur se situant à l’une des extrémités d’un capillaire[2]:
Mobilisation hydrodynamique
Cette technique consiste à appliquer une différence de pression en direction du détecteur afin que s’écoulent les zones focalisées vers celui-ci. Il est à noter que cette technique a pour effet de mélanger les zones focalisées. Elle est donc plutôt inefficace.
Mobilisation chimique
Cette technique consiste à modifier le gradient de pH dans le capillaire en ajoutant un sel neutre à l’une des deux électrodes, par exemple à l’anode, ce qui aura pour effet d’entraîner les bandes focalisées vers le détecteur à la cathode où le pH sera diminué. Ce sont les bandes ayant un point isoélectrique élevé qui seront détectées en premier.
De plus, lors de l’utilisation de la méthode d’IEF par gel, des marqueurs colorés ou l’absorption UV sont utilisés afin de détecter les protéines séparées. Il est à noter qu’il faut d’abord éliminer les ampholytes du gel avant de procéder au marquage, sans quoi les ampholytes seront eux aussi marqués[7].
Montage (sur gel)
Matrices
Les gels pour la focalisation isoélectrique peuvent être achetés ou faits soi-même et il existe plusieurs longueurs et différentes variations pour le gradient de pH qui sert à avoir une meilleure séparation selon l’utilisation. Se procurer un gel provenant d’une compagnie spécialisée permet d’économiser du temps et permet également de s’assurer de la qualité du gel. Afin de choisir un gel approprié, voici quelques éléments qui peuvent aider :
- Utiliser une plus petite bande pour l’étude de la protéine la plus abondante.
- Une plus grande longueur permet d’avoir une plus grande résolution et aussi d’avoir plus de molécules en même temps sur le gel.
- Pour une désintégration totale des protéines, utiliser un gradient de pH de 3 à 10.
- Utiliser un petit écart de pH pour le gradient afin d’étudier une protéine désirée dont le pI est connu.
- Combiner des bandes avec des gradients qui se chevauchent pour une plus grande précision. Par exemple, une bande avec un gradient qui est de pH 4 à 7 et une autre qui a un gradient qui passe de 6 à 11[6].
La polyacrylamide est la matrice la plus utilisée pour le gel de la focalisation isoélectrique. Cependant, on peut également utiliser un gel d’agarose qui permet d’avoir des pores de plus grande taille, permet une coloration et décoloration rapide et n’est pas toxique, contrairement au polyacrylamide qui provient de l’acrylamide, qui est toxique[8]. Le gel d’agarose est utilisé pour l’électrophorèse des protéines et également des acides nucléiques.
Pour empêcher que la porosité n’affecte la vitesse de migration des petites protéines par rapport aux grosses, un gel d’une concentration en acrylamide de 5 à 6 pour cents est satisfaisant, sauf pour les protéines volumineuses, où il faut utiliser des concentrations en bas de 4 pour cent[9]. Par contre, il est à noter que les gels ayant une concentration en acrylamide inférieure à 4 % sont très difficiles à manipuler, puisqu’ils sont très fragiles. Pour remédier à la situation, est possible d’ajouter de l’agarose pour augmenter légèrement la rigidité de la matrice sans influencer la mobilité des protéines.
On doit également tenir compte de l’affinité des protéines pour la matrice utilisée, donc si une protéine a une plus grande affinité, elle migrera moins vite que les autres protéines. Une matrice comme la polyacrylamide est plus inerte et va donc avoir moins d’affinité avec les protéines et par le fait même permettre une meilleure séparation qu’avec le gel d’agarose[1].
D’autres matrices qui sont parfois utilisées pour la focalisation isoélectrique sont le papier, qui n’est plus vraiment utilisé de nos jours, l’acétate de cellulose et l’amidon. Pour le papier, qui contient des molécules de cellulose, il sert à séparer les acides aminés et d’autres petites molécules chargées. Lorsque l’on sépare des acides aminés avec le papier, cela doit cependant être fait à très haut voltage. L’acétate de cellulose est surtout utilisé afin de séparer des protéines sans grande résolution. Sa faible résolution permet seulement de séparer de grands groupes de protéines. Bien que l’acétate de cellulose ne soit pas dispendieux et facile d’emploi, il est beaucoup moins utilisé que l’agarose. Finalement, les gels d’amidons, qui ne sont plus vraiment utilisés, sont poreux et servent également à la séparation des protéines[5].
Tampon
Le tampon à l’anode est un acide fort et celui à la cathode est une base forte. Ceux-ci sont souvent de l’acide phosphorique et de la triéthanoamine[9].
Ampholytes
Comme il a été mentionné précédemment, il faut utiliser des ampholytes pour créer un gradient de pH. Ceux-ci sont un mélange de polyélectrolytes de petites masses molaires. Le choix des différents ampholytes permet de créer des gradients de pH variés selon leur point isoélectrique adapté de façon spécifique à la séparation désirée. En effet, il est alors possible d’avoir des écarts de pH plus restreints d’une amplitude aussi petite que 0,1 unité pour mieux différencier les protéines qui ont des points isoélectriques près les uns des autres, afin augmenter la précision de la séparation. De plus, pour faire une analyse avec des protéines avec des points isoélectriques variées, il est possible de créer un gradient sur une plus vaste gamme de pH avec des intervalles de 2 à 10 et une séparation de 0,4 unité de pH au lieu de 0,1. Dans certains, il même possible d’obtenir une séparation de protéines ayant une différence de point isoélectrique aussi petite que 0,001 unités de pH[10].
Il existe deux façons d’introduire les protéines. En effet, il est possible de les introduire après la mise en place du gradient de pH avec les ampholytes aussi bien qu’avant. Ceci est possible, car les protéines sont plus grosses que les ampholytes. Les protéines ont donc un processus de migration nécessairement plus lent que les ampholytes, leur laissant amplement de temps pour se stabiliser afin de créer le gradient de pH[10].
Cellule d'électrophorèse
Pour effectuer une focalisation isoélectrique sur des analytes, il est nécessaire d’avoir une cellule d’électrophorèse avec une anode et une cathode pour introduire un courant électrique permettant d’établir un gradient de pH dans le gel de polyacrylamide.
Il est à noter que, même si la focalisation isoélectrique ressemble beaucoup à l’électrophorèse, celle-ci comporte plusieurs avantages. Premièrement, le temps de focalisation est différent dans une focalisation isoélectrique par rapport à une électrophorèse normale. Avec la focalisation isoélectrique, le temps de focalisation est moins critique, puisque les protéines ne peuvent pas sortir du gel, car elles s’arrêtent au pH où elles auront atteint leur point isoélectrique. Il faut donc que la migration dure suffisamment longtemps pour permettre aux ampholytes de bien se placer correctement pour créer un gradient immobile et que les protéines aient le temps de se rendre à leur point isoélectrique, mais il n’est pas nécessaire de craindre la perte des analytes[11].
Matériel pour la détermination du pH
Il est possible de déterminer le pH du point isoélectrique des protéines en comparant la distance de migration avec celle de protéines pures où le point isoélectrique est connu. Aussi, l’utilisation d’une microélectrode de surface peut permettre de déterminer le pH où une protéine s’est immobilisée. [11]
Préparation des protéines
Pour la focalisation isoélectrique, on peut focaliser les protéines sous leur forme dénaturée ou à leur état natif. C’est à leur état natif que les protéines sont le plus souvent étudiées puisqu’à cet état, on peut retrouver plusieurs formes différentes de la protéine tandis qu’avec la forme dénaturée, on va seulement voir une bande sur le gel. Les protéines peuvent être dénaturées en les traitant avec de l’urée ou un agent réducteur de thiol, par exemple la dithiothréitol (DTT), ce qui va changer la protéine en polypeptide et va également augmenter drastiquement la solubilité des protéines hydrophobes. Donc, ce sont surtout les protéines qui sont hydrophobes qui vont être dénaturées avant d’être focalisées. Lorsque les protéines sont dénaturées, on doit ajouter de l’urée dans le gel également et dans ces conditions, la température du gel devrait être de 20 °C afin d’éviter la formation d’isocyanate provenant de l’urée, ce qui influencerait les résultats de l’analyse[5].
Marqueurs
Après avoir fini la séparation des protéines par leur pI, il est important de pouvoir observer les bandes qui ont été formées. Pour ce faire, il existe quelques méthodes qui permettent de les voir. La première est la coloration avec divers colorants comme le bleu de Coomassie où l’on doit fixer le gel avec 20 % d’acide trichloroacétique, ensuite colorer le gel avec le bleu de Coomassie dissout dans 40 % de méthanol et 10 % d’acide acétique puis faire une décoloration avec 25 % de méthanol et 10 % d’acide acétique. Le colorant vert solide FCF est un colorant qui n’interfère pas avec les ampholytes que l’on retrouve dans le gel de focalisation isoélectrique, et il fournit une meilleure plage de détection que le bleue de Coomassie[5].
On peut également utiliser un colorant fluorescent, comme le fluorescamine, qui va se lier avec les groupements amines primaires des peptides et former des composés très fluorescents. Cependant cette méthode nécessite un appareil qui va permettre de voir le colorant. Il existe aussi plusieurs méthodes de coloration à l’argent qui peuvent être utilisées. Pour les enzymes, la technique qui peut être utilisée est la détection par zymographie. La technique de coloration va dépendre du type de matrice utilisé et également des molécules étudiées[6].
À ce jour, les marqueurs de type fluorescent qui émettent des longueurs d’onde différentes sont en plein essor[12].
Combinaison avec d'autres méthodes de séparation
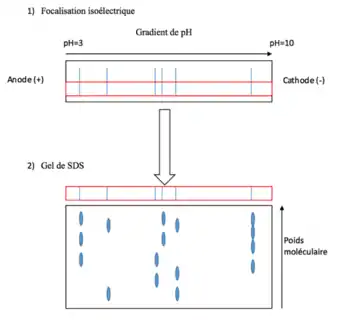
Électrophorèse bidimensionnelle
Afin d’étudier un grand nombre de protéines en même temps, la focalisation isoélectrique est souvent combinée à une électrophorèse dénaturante (gel de SDS), qui sépare les molécules selon leur poids moléculaire. Cette technique, l’électrophorèse bidimensionnelle (gel 2D) a été introduite par Patrick H. O’Farrell en 1975 et devrait permettre d’analyser au maximum 5 000 protéines[13]. L’utilisation de ces deux techniques de séparations permet une grande résolution puisque le pI et le poids moléculaire d’une molécule ne dépendent pas l’un de l’autre. La première dimension du gel 2D est toujours la focalisation isoélectrique et par la suite le gel de SDS[14].
Autres combinaisons
La focalisation isoélectrique peut être combinée à d’autres méthodes de séparations que le gel de SDS qui sépare les molécules en fonction de leurs poids moléculaire. La plupart de ces autres méthodes séparent également les protéines en fonction de leurs tailles ou poids moléculaires.
Par exemple, on peut combiner le gel de focalisation isoélectrique avec un gel d’acétate de cellulose ou un gel d’électrophorèse avec un gradient de pore. Ce dernier gel permet de séparer les protéines dans leurs états natifs en fonction de leur taille moléculaire avec l’aide d’un gel dans lequel la taille des pores diminue graduellement grâce à une augmentation de la concentration du gel[14].
Finalement, la focalisation isoélectrique peut être combinée à l’immunoélectrophorèse. Cette combinaison est surtout utilisée en immunologie et consiste à prendre une bande du gel obtenue avec la focalisation isoélectrique et à la placer dans un gel qui contient une solution d’anticorps spécifiques, ce qui va faire migrer les protéines selon l’affinité des antigènes avec ces anticorps. Cette technique a été utilisée pour l’analyse de protéines urinaires, des amylases salivaires et des protéines sériques humaines[14].
Applications
La focalisation isoélectrique est utilisée pour des analyses en clinique par exemple afin de déterminer la sévérité du diabète chez une personne en déterminant la variation des charges de l’hémoglobine due à des modifications aux groupements amines. Elle permet aussi l’analyse de nourriture ou de graines. Elle est surtout utilisée pour les applications suivantes : la séparation des protéines en fonction de leur pI, le contrôle alimentaire, soit savoir s’il y a des traces animales, permet de faire la différenciation de caséines, des protéines que l’on retrouve dans les produits laitiers, la caractérisation de certaines espèces de plantes comme le blé et finalement, elle est utilisée pour des analyses de routine en clinique entre autres pour l’a-amylase ou pour l’identification des différentes isoenzymes de l’alcool déshydrogénase[6] - [15].
Avantages et inconvénients
La focalisation isoélectrique comporte plusieurs avantages en comparaison avec d’autres méthodes d’électrophorèse.
Premièrement, la focalisation isoélectrique permet d’avoir un plus grand nombre d’échantillons qui sont étudiés sur le même gel sans diminuer la résolution des résultats. Afin d’avoir une meilleure résolution dans d’autres méthodes, il est important d’avoir seulement un petit échantillon. La focalisation isoélectrique ne nécessite pas la dénaturation des protéines, donc pour la suite de l’analyse des résultats, la coloration ou la détection d'anticorps n’est pas gênée par la dénaturation[6].
Si l’on compare la focalisation isoélectrique avec des méthodes qui ont des applications semblables, par exemple la réaction en chaine par polymérase (PCR), elle est plus efficace, a une meilleure expression, est plus économique, facile à réaliser et à analyser. Elle a l’avantage de contrer la diffusion da la molécule hors de son pI puisque lorsque la molécule se retrouve dans une zone qui n’es pas son pI, elle va être chargée et va donc migrer dans sa zone de pI grâce au champ électrique. Cependant, elle peut être difficile à reproduire, le temps d’analyse est long et ce n’est pas une technique facile à automatiser[6].
Notes et références
- (en) Garfin D., Ahuja S., Handbook of isoelectric Focusing and Proteomics, First Edition, Californie, Academic Press, , 334 p.
- Skkog D. A., WestD. M., Holler F. J., Crouch S. R., Principes d'Analyse instrumentale, Bruxelles, Belgique, Groupe De Boeck, , 957 p.
- (en) Luner, S. J., & Kolin, A., « A New Approach to Isoelectric Focusing and Fractionation of Proteins in a pH Gradient », Proceedings of the National Academy of Sciences of the United States of America,
- Skoog D. A., WestD. M., Holler F. J., Crouch S. R., Chimie Analytique, Bruxelles, Belgique, Groupe DE Boeck, , 1116 p.
- Voet D., Voet J.G., Biochimie, Bruxelles, Belgique, Groupe De Boeck, , 1585 p.
- (en) « Isoelectric focusing », sur sigmaaldrich.com
- Lodish, Berk, Matsudaira, Kraiser, Kreger, Scott, Zipursky, Darnell, Biologie moléculaire de la cellule, Bruxelles, Belgique, Groupe De Boeck,
- « Fiche complète pour Acrylamide - CNESST », sur www.csst.qc.ca (consulté le )
- (en) 8 Boyer, R.F., Modern Experimental Biochemistry, USA, Addison-Wesley Publishing Company, , 132 p.
- (en) Lata G.F., Dryer. R.L., Experimental Biochemistry, New York, Oxford University Press, , 514 p.
- (en) Plummer D.T., An introduction to practical biochemistry (3e édition), Londres, Angleterre, McGraw Hill Book Co., , 332 p.
- Durand G., Beaudeux J., Biochimie médicale : marqueurs actuels et perspectives, Paris, France, Éditions Lavoisier, , 607 p.
- (en) Patrick H. O'Farrell, « High resolution two-demensional electrophoresis of proteins », J Biol Chemestry, (lire en ligne)
- (en) Nicholas Catsimpoolas, Isoelectric focusing, New York, Academic Press Inc, , 265 p. (ISBN 0-12-163950-9)
- (en) John A. Duley, Owen Harris et Roger S. Holmes, « Analysis of Human Alcohol- and Aldehyde-Metabolizing Isozymes by Electrophoresis and Isoelectric Focusing », Alcoholism: Clinical and Experimental Research, vol. 9, , p. 263–271 (ISSN 1530-0277, DOI 10.1111/j.1530-0277.1985.tb05747.x, lire en ligne, consulté le )