Pile à combustible à oxyde solide
Les piles à combustibles à oxydes solides (ou SOFC selon l'acronyme anglais de Solid oxide fuel cells) sont prévues essentiellement pour les applications stationnaires avec une puissance de sortie allant de 1 kW à 2 MW. Elles fonctionnent à très hautes températures, typiquement entre 450 °C[1] et 1 000 °C (723 et 1273 K). Leurs rejets gazeux peuvent être utilisés pour alimenter une turbine à gaz secondaire afin d'accroître le rendement électrique. Le rendement peut atteindre les 70 % dans les systèmes hybrides, appelés systèmes à chaleur et puissance combinées ou de cogénération (en anglais : combined heat and power device ou CHP). Dans ces piles, les ions oxygène sont déplacés au travers d'un oxyde solide pris comme électrolyte à haute température afin de réagir avec l'hydrogène du côté anode. En raison de la haute température de fonctionnement des SOFC, il n'y a pas besoin de catalyseur onéreux, ce qui est le cas des piles à combustible à membrane échangeuse de protons (du platine par exemple). Ce qui signifie que les SOFC ne subissent pas d'empoisonnement catalytique par le monoxyde de carbone, et cela en fait par conséquent des piles hautement adaptables. Les SOFC ont été utilisés avec du méthane, du propane, du butane, du gaz de fermentation, de la biomasse gazéifiée et des vapeurs de peinture. Cependant, les composés soufrés présents dans le combustible doivent être éliminés avant de pénétrer dans la pile, ce qui peut être aisément fait grâce à un lit de charbon actif ou un absorbant à base de zinc.
L'expansion thermique demande un chauffage lent et uniforme à son début : habituellement, 8 heures ou plus sont nécessaires. Des géométries micro-tubulaires permettent de raccourcir les temps de démarrage, parfois jusqu'à 13 minutes.
Description
Contrairement à la plupart des autres types de piles à combustible, les SOFC peuvent avoir de multiples géométries[2] :
- une géométrie plane est le type de géométrie en sandwich employée par la plupart des piles à combustible, dans laquelle l'électrolyte est "sandwiché" entre les électrodes ;
- une géométrie tubulaire par laquelle l'air ou le combustible est amené à passer à l'intérieur du tube et l'autre gaz par l'extérieur. Le profil tubulaire est avantageux car il y est plus facile de sceller le combustible et de le séparer de l'air que dans une géométrie plane.
La performance de la géométrie plane est actuellement meilleure que celle de la géométrie tubulaire en raison de sa plus faible résistance.
Fonctionnement
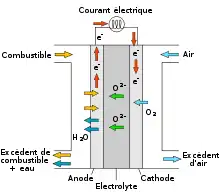
Une SOFC est constituée de quatre couches, trois d'entre elles étant des céramiques (d'où leur nom). Une pile unique (généralement dénommée « cellule ») est constituée de ces quatre couches superposées possède une épaisseur typique de quelques millimètres. Des centaines de ces piles sont alors superposées en série pour former ce qui est couramment appelé "pile à combustible à oxyde solide". Les céramiques utilisées dans les SOFC ne deviennent actives électriquement et ioniquement que lorsqu'elles atteignent une très haute température, et, par conséquent, les empilements doivent atteindre des températures de l'ordre de 600 à 1 200 °C.
Cathode
La couche céramique de la cathode doit être poreuse, ce qui permet à l'air d'y circuler, ainsi que dans l'électrolyte. Il y a différents types de matériaux céramiques utilisés pour la cathode, mais tous doivent être conducteurs électriques. La cathode est le côté négatif de la pile au travers duquel les électrons circulent. C'est le côté exposé à l'air dont le rôle est d'utiliser des électrons afin de réduire les molécules d'oxygène de l'air (O2) en ion oxyde (O2−).
Électrolyte
L'électrolyte est la couche dense et imperméable aux gaz de chaque pile qui agit comme une membrane séparant le combustible du côté de l'anode de l'air du côté de la cathode. Il y a de nombreux matériaux céramiques étudiés pour leur utilisation comme électrolyte, mais les plus communs sont basés sur l'oxyde de zirconium. En plus d'être imperméable au gaz, l'électrolyte doit être un isolant électrique : les électrons résultant de la réaction d'oxydation du côté anode sont contraints à se déplacer au travers du circuit externe avant de rejoindre le côté cathode. Le requis le plus important pour l'électrolyte, cependant, est qu'il doit être capable de conduire les ions oxygène de la cathode vers l'anode. Pour cette raison, la fiabilité d'un matériau électrolytique se mesure en termes de conductivité ionique.
Anode
La couche céramique constituant l'anode doit être très poreuse afin de permettre au combustible d'atteindre l'électrolyte. À l'instar de la cathode, elle doit conduire l'électricité. Le matériau le plus couramment utilisé est un cermet constitué de nickel mélangé avec le matériau céramique utilisé pour l'électrolyte dans cette pile particulière. L'anode est communément la couche la plus profonde et la plus solide de chaque pile individuelle, et est parfois celle qui fournit les propriétés mécaniques. D'un point de vue électrochimique, le rôle de l'anode est d'utiliser les ions oxygène diffusant dans l'électrolyte afin d'oxyder le combustible (hydrogène). La réaction d'oxydation entre les ions oxygène et le combustible (hydrogène) produit de l'eau et de l'électricité.
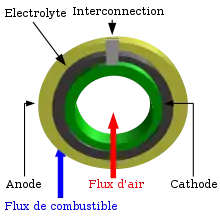
Interconnexion
L'interconnexion peut être une couche métallique ou céramique disposée entre chaque pile individuelle. Son rôle est d'assurer une connexion en série de chaque pile, combinant ainsi la production de chacune. En raison de son exposition aux côtés réducteurs et oxydants de chaque pile aux hautes températures, l'interconnexion doit être extrêmement stable. C'est pourquoi les céramiques sont plus stables sur le long terme que les métaux comme matériaux d'interconnexion. Cependant, ces céramiques sont très onéreuses. Heureusement, les matériaux métalliques peu coûteux deviennent plus intéressants au fur et à mesure que les SOFC à plus basse température (600 à 800 °C) sont développées.
La recherche sur les SOFC
La recherche est actuellement orientée vers les SOFC fonctionnant à "basse" température (vers 600 °C) dans le but de décroître les coûts, en permettant l'utilisation de matériaux métalliques avec de meilleurs propriétés mécaniques et une meilleure conductivité thermique.
La recherche vise aussi à réduire les temps de démarrage afin de mettre en œuvre les SOFC dans des applications mobiles. En raison de leur flexibilité vis-à-vis des combustibles utilisés, elles sont susceptibles de fonctionner avec du gazole partiellement reformé, ce qui en fait des unités auxiliaires potentielles pour certaines applications (camions réfrigérés).
Certaines grandes firmes développent des SOFC comme unités auxiliaires dans les automobiles. Des SOFC à hautes-températures généreront l'électricité nécessaire pour un moteur afin de le rendre plus petit et plus efficace. Les SOFC marchent avec le même gazole ou essence que le moteur aidé, et conserveront le conditionnement de l'air et les autres systèmes électriques nécessaires en marche lorsque le moteur ne fonctionne pas (arrêts aux feux de signalisation, par exemple). D'autres produisent des SOFC par sérigraphie sur des matériaux céramiques peu chers, ou des turbines à gaz hybrides consommant du gaz naturel pour des applications de génération de puissance allant jusqu'au mégawatt (firme Rolls-Royce ).
Certaines industries développement une SOFC à bas coût et à basse température (500 à 600 °C) utilisant un oxyde de cérium et gadolinium en remplacement des actuelles céramiques industrielles standard (zircone stabilisée à l'yttrium), et qui permet d'utiliser de l'acier inoxydable afin de supporter la céramique.
En 2008, des chercheurs du laboratoire « Sciences chimiques de Rennes », en collaboration avec une équipe de l'institut Laue-Langevin, à Grenoble, et de l'université de Kyoto, au Japon, ont mis au point un nouvel oxyde qui ouvre la voie à des piles plus efficaces[3]. Le nouveau composé est un oxyde constitué de fer et de strontium, de formule chimique SrFeO2. Son atout principal est justement de pouvoir réagir avec ces mêmes ions oxygène dès 280 °C. Il prépare l'arrivée de piles à la fois plus robustes dans le temps et moins gourmandes en chaleur pour fonctionner.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Solid oxide fuel cell » (voir la liste des auteurs).