Phénylhydroxylamine
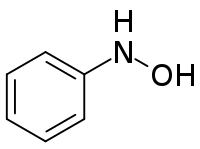
La phénylhydroxylamine, plus précisément la β-phénylhydroxylamine, est un composé organique aromatique de formule C6H5NHOH. C'est un intermédiaire du couple rédox aniline (C6H5NH2) / nitrosobenzène (C6H5NO). La phénylhydroxylamine possède un isomère de constitution, l'α-phénylhydroxylamine ou O-phénylhydroxylamine, C6H5ONH2.
| Phénylhydroxylamine | |
| |
| Identification | |
|---|---|
| Nom UICPA | N-phénylhydroxylamine |
| Synonymes |
β-phénylhydroxylamine; N-hydroxyaniline; N-hydroxybenzéneamine; hydroxylaminobenzène |
| No CAS | |
| No ECHA | 100.002.614 |
| SMILES | |
| InChI | |
| Apparence | aiguilles jaunes |
| Propriétés chimiques | |
| Formule | C6H7NO [Isomères] |
| Masse molaire[1] | 109,125 9 ± 0,005 8 g/mol C 66,04 %, H 6,47 %, N 12,84 %, O 14,66 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
La phénylhydroxylamine peut être préparée par réduction du nitrobenzène (C6H5NO2) par le zinc, en présence de chlorure d'ammonium (NH4Cl), suivie par une cristallisation. Des aiguilles jaunes se forment alors dans l'eau saturée en sels[2] - [3]. Elle peut aussi être préparée par hydrogénation par transfert du nitrobenzène en utilisant l'hydrazine comme source en hydrogène, et un catalyseur à base de rhodium[4]. Le produit peut ensuite être purifié de la contamination en NaCl par extraction dans la benzène, par précipitation avec l'éther de pétrole.
Réactions
C6H5NHOH est instable si chauffée, et en présence d'acides forts elle se réarrange facilement en 4-aminophénol. L'oxydation de la phénylhydroxylamine par le dichromate est une technique pratique pour la préparation du nitrosobenzène.
La phénylhydroxylamine se condense avec le benzaldéhyde pour former la diphénylnitrone, un dipôle 1,3 bien connu[5] :
- C6H5NHOH + C6H5CHO → C6H5N(O)=CHC6H5 + H2O
La phénylhydroxylamine peut réagir avec l'ammoniac et une source en ion NO+, par exemple le nitrite de butyle, pour former le cupferron :
- C6H5NHOH + C4H9ONO + NH3 → NH4[C6H5N(O)NO] + C4H9OH
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Phenylhydroxylamine » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- E. Bamberger “Ueber das Phenylhydroxylamin” Chemische Berichte, volume 27 1548-1557 (1894). E. Bamberger, "Ueber die Reduction der Nitroverbindungen" Chemische Berichte, volume 27 1347-1350 (1894) (first report).
- O. Kamm, Phenylhydroxylamine, Org. Synth., coll. « vol. 1 », , p. 445
- P. W. Oxley, B. M. Adger, M. J. Sasse, and M. A. Forth, N-Acetyl-N-Phenylhydroxylamine via Catalytic Transfer Hydrogenation of Nitrobenzene using Hydrazine and Rhodium on Carbon, Org. Synth., coll. « vol. 16 », , p. 16
- I. Brüning, R. Grashey, H. Hauck, R. Huisgen, H. Seidl, 2,3,5-Triphenylisoxazolidine, Org. Synth., coll. « vol. 5 », , p. 1124