Perrhénate d'ammonium
Le perrhénate d'ammonium est le sel d'ammonium de l'acide perrhénique. Soluble dans l'eau[5], il a été découvert peu après le rhénium.
| Perrhénate d'ammonium | |||
| |||
 | |||
| __ N __ H __ Re __ O | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | oxido(trioxo)rhénium d'azanium | ||
| No CAS | |||
| No ECHA | 100.033.690 | ||
| No CE | 237-075-6 | ||
| PubChem | 3084163 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre cristalline blanche inodore[1] | ||
| Propriétés chimiques | |||
| Formule | NH4ReO4 | ||
| Masse molaire[2] | 268,243 ± 0,003 g/mol H 1,5 %, N 5,22 %, O 23,86 %, Re 69,42 %, |
||
| pKa | 7,1 à 20 °C, cc = 63 g/l[1] | ||
| Propriétés physiques | |||
| T° fusion | 313-314 °C (décomp.)[3] 395 °C (décomp.)[1] |
||
| Solubilité | 62,3 g·l-1 à 20 °C[3] | ||
| Masse volumique | 3,97 g·cm-3 à 25 °C[3] | ||
| T° d'auto-inflammation | inautoinflammable[3] | ||
| Cristallographie | |||
| Classe cristalline ou groupe d’espace | (no 88) [4] |
||
| Précautions | |||
| SGH[1] | |||
  |
|||
| Transport[1] | |||
|
|||
| Écotoxicologie | |||
| DL50 | > 2 000 mg/kg (rat, oral)[3] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Synthèse et structure
Le perrhénate d'ammonium peut être préparé à partir de pratiquement toutes les sources courantes de rhénium. Le métal, les oxydes et les sulfures peuvent être oxydés avec de l'acide nitrique et la solution résultante traitée avec de l'ammoniaque. Alternativement, une solution aqueuse de Re2O7 peut être traitée avec de l'ammoniac, suivie d'une cristallisation[6] - [7].
Donc le perrhénate d'ammonium est obtenu par réaction d'une solution d'acide perrhénique avec de l'ammoniac[4]:
- NH3 + HReO4 → NH4ReO4
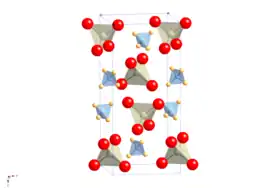
Le perrhénate d'ammonium présente une structure cristalline tétragonale de type scheelite avec le groupe d'espace I41/a (no 88) et les paramètres de réseau a = 587,1 pm et c = 1294,2 pm[4].
Cette structure cristalline est celle de la scheelite, dans laquelle le cation atomique est remplacé par le cation moléculaire de l'ammonium[8]. Elle subit une transition d'orientation d'ordre moléculaire sous refroidissement sans changement de groupe d'espace, mais avec un changement fortement anisotrope de la forme de la cellule élémentaire, ce qui confère la propriété inhabituelle d'avoir un coefficient RQN du rhénium positif en température et en pression[9].
NH4ReO4 peut être considéré comme la structure prototype d'une famille de scheelites d'ammonium, comprenant le pertechnétate (NH4TcO4), le periodate (NH4IO4), le tétrachlorothallate (NH4TlCl4) et le tétrachloroindate (NH4InCl4)[9].
Propriété
Le perrhénate d'ammonium se décompose à 400 °C en oxyde de rhénium(IV), ReO2, en eau et en diazote. De la poudre de rhénium pur peut être produite à partir de ce perrhénate en le chauffant en présence d'hydrogène[6] :
- 2 NH4ReO4 + 7 H2 → 2 Re + 8 H2O + 2 NH3
Le chauffage doit être fait lentement car le perrhénate d'ammonium se décompose en Re2O7 volatil à partir de 250 °C. Lorsqu'il est chauffé dans un tube scellé à 500 °C, le perrhénate d'ammonium se décompose en dioxyde de rhénium[6] :
- 2NH4ReO4 → 2ReO2 + N2 + 4 H2O
Les organohydrazinures de rhénium(III) formés lors de la réduction du perrhénate d'ammonium avec la 2-hydrazinopyridine et la triphénylphosphine pourraient être utilisés en tant que radiopharmaceutiques[3].
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Ammonium perrhenate » (voir la liste des auteurs) et en allemand « Ammoniumperrhenat » (voir la liste des auteurs)..
- Entrée « Ammonium perrhenate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 9 septembre 2019 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Ammonium perrhenate 99.999% trace metals basis, consultée le 10 septembre 2019. + (pdf) fiche MSDS.
- Georg Brauer, Handbuch der präparativen anorganischen Chemie. 3, Enke, Stuttgart, 1981, chapitre III, p. 1633. (ISBN 3-432-87823-0).
- « Distribution et vente de Perrhénate d'ammonium, NH4ReO4 », sur www.todini.com (consulté le )
- O. Glemser, "Ammonium Perrhenate" in Handbook of Preparative Inorganic Chemistry, 2d Ed. édité par G. Brauer, Academic Press, 1963, New York, vol. 1, pp. 1476–85.
- Richard J. Thompson et al., Ammonium Perrhenate, Inorganic Syntheses, 1966, vol. 8, pp. 171–173. DOI 10.1002/9780470132395.ch44.
- I. P. Swainson et R. J. C. Brown, Refinement of ammonium perrhenate structure using a pseudo-spin model for the ammonium ion orientation, Acta Crystallographica, 1997, vol. B53, pp. 76–81. DOI 10.1107/S0108768196011160.
- R. J. C. Brown et S. L. Segel, 187Re, 14N, and 2H nuclear quadrupole couplings in NH4ReO4: Evidence for a possible phase transition, Journal of Chemical Physics, 1977, vo. 67(7), pp. 3163–7. DOI 10.1063/1.435229.
 flacons de perrhénate d'ammonium
flacons de perrhénate d'ammonium du perrhénate d'ammonium
du perrhénate d'ammonium


