Peroxyde de magnésium
Le peroxyde de magnésium, de formule MgO2, est un peroxyde, en poudre fine, inodore, de couleur blanche à blanc cassé. Il est comparable au peroxyde de calcium en ce qu'il libère également de l'oxygène en se décomposant à une vitesse contrôlée avec de l'eau. Dans le commerce, le peroxyde de magnésium se retrouve souvent sous une forme associée avec l'hydroxyde de magnésium.
| Peroxyde de magnésium | |
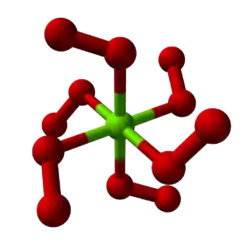
| |
| Structure cristalline du peroxyde de magnésium, MgO2[1]. | |
| Identification | |
|---|---|
| Nom UICPA | Magnesium peroxide |
| Synonymes |
dioxyde de magnésium, bioxyde de magnésium, UN 1476 |
| No CAS | |
| No ECHA | 100.034.928 |
| No CE | 238-438-1 |
| PubChem | 6174561745 |
| SMILES | |
| InChI | |
| Apparence | poudre couleur blanche à blanc cassé, fine et inodore |
| Propriétés chimiques | |
| Formule | MgO2 |
| Masse molaire[2] | 56,303 8 ± 0,001 2 g/mol Mg 43,17 %, O 56,83 %, |
| Propriétés physiques | |
| T° fusion | 223 °C |
| T° ébullition | 350 °C |
| Solubilité | insoluble |
| Miscibilité | (solvant, ) |
| Masse volumique | 3 g·cm-3 |
| Cristallographie | |
| Système cristallin | cubique |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | (no Pa3) 205 |
| Précautions | |
| SGHO3 | |
| Unités du SI et CNTP, sauf indication contraire. | |
Structure
Le dioxygène (O2), de la même manière que le diazote (N2), a la capacité de se lier soit latéralement, soit aux extrémités. La structure de MgO2 a été définie comme une forme triangulaire avec la molécule d'O2 se liant latéralement au magnésium. Cette disposition résulte du fait que le magnésium donne une charge à l'oxygène et crée un Mg2+O22−. La liaison entre O2 et l'atome de magnésium a une énergie de dissociation approximative de 90 kJ mol-1[3].
À l'état solide, MgO2 a une structure cristalline cubique de type pyrite avec des ions Mg2+ à 6 coordonnées et des groupes peroxyde O22−, selon les données expérimentales[4] et la prédiction évolutive de la structure cristalline[5], cette dernière aurait une transition de phase à la pression de 53 Gigapascal vers une structure tétragonale avec des ions Mg2+ à 8 coordonnées. Alors que dans des conditions normales, MgO2 est un composé métastable (moins stable que MgO + 12O2), à des pressions supérieures à 116 GPa, il est prédit qu'il devienne thermodynamiquement stable dans la phase tétragonale. Ce qui a été confirmé expérimentalement par synthèse dans une cellule à enclume en diamant chauffée au laser[6].
Synthèse
Le peroxyde de magnésium peut être obtenu en mélangeant de l'oxyde de magnésium avec du peroxyde d'hydrogène, ce qui produit aussi de l'eau. Ceci étant une réaction exothermique doit être refroidi et maintenu autour de 30 à 40 °C. Il est également important d'éliminer le fer autant que possible de l'environnement de réaction en raison de sa capacité à catalyser la dégradation du peroxyde. Les stabilisants d'oxygène tels que le silicate de sodium (Na2SiO3) peuvent également être utilisés pour aider à prévenir la dégradation prématurée du peroxyde. Quoi qu'il en soit, un bon rendement de cette réaction n'est que d'environ 35 %[7].
MgO + H2O2 → MgO2 + H2O
Les rendements élevés sont encore compliqués par le fait que MgO2 réagit avec l'eau pour dégrader le peroxyde en hydroxyde de magnésium, également connu sous le nom de lait de magnésie.
Applications
Le peroxyde de magnésium est un composé stable libérant de l'oxygène, qui est utilisé dans les industries agricoles et environnementales. Il est utilisé pour réduire la contamination dans les eaux souterraines, dans la bioremédiation des sols pollués et peut améliorer la qualité du sol pour le couvert végétal, agricole ou spontané, et donc favorise la croissance et le métabolisme des plantes. Il est également utilisé dans l'industrie aquacole pour la bioremédiation.
Le peroxyde de magnésium est souvent utilisé comme source d'oxygène pour les organismes aérobies dans le traitement sanitaire et l'élimination des déchets biologiques. Étant donné que la décomposition des Hydrocarbures dans le sol est généralement plus rapide dans des conditions aérobies, MgO2 peut également être ajouté aux tas de compost ou dans le sol pour accélérer les activités microbiennes et réduire les odeurs produites au cours du processus[8].
Dans certaines circonstances, il a également été démontré que le peroxyde de magnésium inhibe la croissance des bactéries, en particulier, celle des bactéries sulfato-réductrices. Alors que l'oxygène se dissocie lentement, il est théorisé que le MgO2 peut alors agir pour déplacer le sulfate agissant normalement comme accepteur d'électrons terminal dans leur chaîne de transport d'électrons[9].
Toxicité
Le peroxyde de magnésium est un irritant dont le contact peut provoquer des rougeurs, des démangeaisons, un gonflement et brûler la peau et les yeux. Son inhalation peut également provoquer l'irritation des poumons, du nez et de la gorge, ainsi qu'une toux. Une exposition à long terme peut entraîner des lésions pulmonaires, une dyspnée (essoufflement chronique) et une oppression thoracique. Son ingestion peut provoquer de nombreux effets indésirables, notamment : ballonnements, éructations, douleurs abdominales, irritation de la bouche et de la gorge, nausées, vomissements et diarrhée[10] - [11].
Sur le plan environnemental, le peroxyde de magnésium n'est pas un composé naturel, mais n'est pas connu pour persister dans l'environnement pendant des périodes prolongées, sous sa forme complète, ou pour se bioaccumuler. Sa décomposition naturelle produit de l'hydroxyde de magnésium (Mg(OH)2), du dioxygène, et de l'eau.
En cas de déversement, le MgO2 doit être confiné et isolé de toutes les voies navigables, des égouts et aussi des matériaux combustibles ou des produits chimiques, y compris le papier, le tissu et le bois[8].
Réactions environnementales courantes
Le magnésium existe dans la haute atmosphère sous différentes formes moléculaires. En raison de sa capacité à réagir avec l'oxygène courant et les composés carbone-oxygène simples, le magnésium peut exister dans des composés oxydés, notamment MgO2 ,OMgO2, MgO et O2MgO2[12].
- MgCO3 + O → MgO2+ CO2
- OMgO2 + O → MgO2 + O2
- MgO + O3 → MgO2 + O2
- MgO2 + O2 → O2MgO2
- MgO2 + O → MgO + O2
Au contact de l'eau, il se décompose par les réactions :
- MgO2 + 2H2O → Mg(OH)2 + H2O2
- 2H2O2 → 2H2O + O2
Références
- (en) Arne Kjekshus, Trond Rakke, Oddmund Strømme et G. Olofsson, « Preparation and Properties of Magnesium, Copper, Zinc and Cadmium Dichalcogenides. », Acta Chemica Scandinavica, vol. 33a, , p. 617–620 (ISSN 0904-213X, DOI 10.3891/acta.chem.scand.33a-0617, lire en ligne, consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Richard J. Plowright, Thomas J. McDonnell, Timothy G. Wright et John M. C. Plane, « Theoretical Study of Mg+−X and [X−Mg−Y]+Complexes Important in the Chemistry of Ionospheric Magnesium (X, Y = H2O, CO2, N2, O2, and O) », Journal of Physical Chemistry, vol. 113, no 33, , p. 9354–9364 (PMID 19637880, DOI 10.1021/jp905642h, Bibcode 2009JPCA..113.9354P).
- (en) Vannerberg N., « The formation and structure of magnesium peroxide », Ark. Kemi, vol. 14, , p. 99–105.
- (en) Qiang Zhu, Artem R. Oganov et Andriy O. Lyakhov, « Novel stable compounds in the Mg–O system under high pressure », Physical Chemistry Chemical Physics, vol. 15, no 20, , p. 7696–700 (PMID 23595296, DOI 10.1039/c3cp50678a, Bibcode 2013PCCP...15.7696Z).
- (en) Sergey S. Lobanov, Qiang Zhu, Nicholas Holtgrewe et Clemens Prescher, « Stable magnesium peroxide at high pressure », Scientific Reports, vol. 5, no 1, , p. 13582 (PMID 26323635, PMCID 4555032, DOI 10.1038/srep13582, Bibcode 2015NatSR...513582L, arXiv 1502.07381).
- (en) Mark A. Shand, The Chemistry and Technology of Magnesia, John Wiley & Sons, (ISBN 978-0-471-98056-8).
- (en) M. Vidali, « Bioremediation. An overview », Pure and Applied Chemistry, vol. 73, no 7, , p. 1163–1172 (DOI 10.1351/pac200173071163).
- (en) Yu-Jie Chang, Yi-Tang Chang et Chun-Hsiung Hung, « The use of magnesium peroxide for the inhibition of sulfate-reducing bacteria under anoxic conditions », J Ind Microbiol Biotechnol, vol. 35, no 11, , p. 1481–1491 (PMID 18712535, DOI 10.1007/s10295-008-0450-6).
- (en) « Product Safety Summary: Magnesium Peroxide », Solvay America Inc. (consulté le ).
- (en) Richard P. Pohanish, Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens, William Andrew, , 1645–1646 p. (ISBN 978-1437778700).
- (en) John M. C. Plane et Charlotte L. Whalley, « A New Model for Magnesium Chemistry in the Upper Atmosphere », Journal of Physical Chemistry A, vol. 116, no 24, , p. 6240–6252 (PMID 22229654, DOI 10.1021/jp211526h, Bibcode 2012JPCA..116.6240P).
