Oxyde de plomb(II,IV)
L'oxyde de plomb(II,IV) ou tétroxyde de plomb, appelé également plomb rouge, est un composé inorganique de formule Pb3O4. C'est un solide rouge vif à orange, utilisé notamment dans la fabrication de pigments, de batteries, du cristal et d'apprêt antirouille. C'est un exemple de composé à états d'oxydation multiples, constitué de plomb(II) et de plomb(IV)[3]. Il est présent dans la nature sous forme d'un minéral, le minium.
| Oxyde de plomb(II,IV) | |

| |
| Identification | |
|---|---|
| Nom UICPA | Oxyde de plomb(II,IV) |
| Synonymes |
Oxyde de plomb |
| No CAS | |
| No ECHA | 100.013.851 |
| No CE | 215-235-6 |
| Apparence | cristaux ou poudre rouges[1]. |
| Propriétés chimiques | |
| Formule | Pb3O4 |
| Propriétés physiques | |
| T° fusion | (décomposition) : 500 °C[1] |
| Solubilité | dans l'eau : nulle[1], le plus souvent dissous dans une solution de potasse caustique concentrée à haute température |
| Masse volumique | 9,1 g·cm-3[1] |
| Précautions | |
| SIMDUT[2] | |
 D2A, |
|
| Directive 67/548/EEC | |
| Unités du SI et CNTP, sauf indication contraire. | |
Structure
L'oxyde de plomb(II,IV) cristallise dans une structure tétragonale à température ambiante, mais évolue vers une structure orthorhombique (symbole de Pearson oP28, groupe d'espace = Pbam, no 55) en dessous de −103 °C environ. Cette transition de phase ne change que la symétrie du cristal, et modifie légèrement les distances interatomiques et les angles[4].
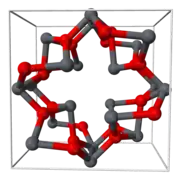
 Structure cristalline du plomb rouge.
Structure cristalline du plomb rouge.
Synthèse
L'oxyde de plomb(II,IV) peut être préparé par calcination de l'oxyde de plomb(II) dans l'air vers 450-480 °C[5] :
- 6 PbO + O2 → 2 Pb3O4
Le produit d'une telle réaction est généralement impur, contenant toujours du PbO. Pour le purifier, PbO peut en être extrait par l'ajout d'une solution d'hydroxyde de potassium :
- PbO + KOH + H2O → K[Pb(OH)3]
Il est également possible de le préparer par recuit du carbonate de plomb(II) dans l'air :
- 6 PbCO3 + O2 → 2 Pb3O4 + 6 CO2
Une autre méthode passe par le recuit oxydatif du blanc de plomb :
- 3 Pb2CO3(OH)2 + O2 → 2 Pb3O4 + 3 CO2 + 3H2O
En solution, l'oxyde de plomb(II,IV) peut être préparé par réaction entre le plombate de potassium et l'acétate de plomb(II), produisant un monohydrate d'oxyde de plomb(II,IV) insoluble, jaune, Pb3O4·H2O, qui peut ensuite être transformé en forme anhydre par chauffage doux :
- K2PbO3 + 2 Pb(OCOCH3)2 + H2O → Pb3O4 + 2 KOCOCH3 + 2 CH3COOH
Le minium naturel est plutôt rare, se formant uniquement dans conditions extrêmement oxydantes sur du minerai de plomb. Les meilleurs spécimens viennent de Broken Hill, en Nouvelle-Galles du Sud (Australie), où ils se sont formés à la suite de l'incendie d'une mine[6].
Voir aussi
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Lead(II,IV) oxide » (voir la liste des auteurs).
- TETRAOXYDE DE PLOMB, Fiches internationales de sécurité chimique
- « Tétroxyde de plomb » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann, (ISBN 0080379419)
- Gavarri, Dominique Weigel et A. W. Hewat, « Oxydes de plomb. IV. Évolution structurale de l'oxyde Pb3O4 entre 240 et 5 °K et mécanisme de la transition », Journal of Solid State Chemistry, vol. 23, nos 3–4, , p. 327 (DOI 10.1016/0022-4596(78)90081-6)
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a15_249), « Lead Compounds »
- Minium