Nucléomoduline
Les nucléomodulines constituent une famille de protéines bactériennes pénétrant dans le noyau des cellules eucaryotes [1].
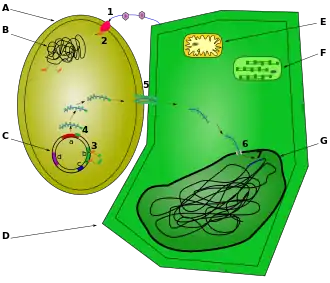
Ce terme vient de la contraction entre « nucleus » et « modulines », qui sont des molécules microbiennes qui modulent le comportement des cellules eucaryotes. Les nucléomodulines sont produites par des bactéries pathogènes ou symbiotiques. Elles agissent sur divers processus dans le noyau: le remodelage de la structure de la chromatine [2] - [3] - [4] - [5] - [6] - [7] - [8] - [9] - [10] - [11] - [12], la transcription [13] - [14], l'épissage de l'ARN pré-messager [15] - [16], la division cellulaire [17]. En agissant sur l'expression de gènes dans les cellules hôtes ou sur la division cellulaire, les nucléomodulines contribuent à la virulence ou à la symbiose bactérienne.
L'identification des nucléomodulines dans plusieurs espèces de bactéries pathogènes de l’homme et des animaux et des plantes, a conduit à l'émergence du concept selon lequel un contrôle direct du noyau est l'une des stratégies les plus sophistiquées utilisées par les microbes pour contourner les défenses de l'hôte.
Les nucléomodulines peuvent être directement sécrétées dans le milieu intracellulaire après pénétration des bactéries dans le cytoplasme, comme c'est le cas pour Listeria monocytogenes, ou bien elles peuvent être injectées depuis le milieu extracellulaire ou depuis des organites intracellulaires (e.g. des vacuoles) à l'aide d'un système de sécrétion bactérien de type III ou IV, aussi appelée "seringue moléculaire".
Plus récemment, il a été montré que certaines d'entre elles, telles que YopM de Yersinia pestis et IpaH9.8 de Shigella flexneri, présentent un domaine de transduction membranaire leur conférant la capacité de pénétrer de façon autonome les cellules eucaryotes [18].
La diversité des mécanismes moléculaires mis en jeu par les nucléomodulines[1] - [19] - [20] en font une source d'inspiration pour de nouvelles biotechnologies. Elles sont de véritables nano-machines capables de détourner une multitude de processus nucléaire. En recherche, les nucléomodulines font l'objet d'études approfondies qui ont également permises la découverte de nouveaux régulateurs nucléaires humains, comme celle du régulateur épigénétique BAHD1 [8].
Quelques exemples
Agrobacterium tumefaciens, responsable de la galle du collet, produit un arsenal de protéines Vir, dont VirD2 et VirE2, permettant l'intégration précise d'un morceau de son ADN, nommé ADN-T, dans celui de la plante hôte [21](voir image).
Listeria monocytogenes, responsable de la listériose, peut moduler l'expression de gènes de l'immunité. Un des mécanismes en jeu fait intervenir la protéine bactérienne LntA qui inhibe la fonction du régulateur épigénétique BAHD1. L'action de cette nucléomoduline est associé à la décompaction de la chromatine et l'activation de gènes de réponse aux interférons [8] - [22].
Shigella flexneri, responsable de la shigellose, sécrète la protéine IpaH9.8 capable de cibler une protéine de l'épissage des ARNm interférant ainsi la production d'isoformes protéiques et la réponse inflammatoire chez l'Homme [16].
Legionella pneumophila, responsable de la légionellose sécrète une enzyme à activité histone méthyltransferase capable de méthyler les histones à divers loci des chromosomes [23] ou au niveau de l’ADN ribosomique (ADNr) dans le nucléole [24].
Notes et références
- Hélène Bierne et Pascale Cossart, « When bacteria target the nucleus: the emerging family of nucleomodulins », Cellular Microbiology, vol. 14, no 5, , p. 622–633 (ISSN 1462-5822, PMID 22289128, DOI 10.1111/j.1462-5822.2012.01758.x, lire en ligne, consulté le )
- E. Skrzypek et al., « Targeting of the Yersinia pestis YopM protein into HeLa cells and intracellular trafficking to the nucleus », Molecular Microbiology, vol. 30, no 5, , p. 1051–1065 (ISSN 0950-382X, PMID 9988481, DOI 10.1046/j.1365-2958.1998.01135.x, lire en ligne, consulté le )
- Hongtao Li et al., « The phosphothreonine lyase activity of a bacterial type III effector family », Science (New York, N.Y.), vol. 315, no 5814, , p. 1000–1003 (ISSN 1095-9203, PMID 17303758, DOI 10.1126/science.1138960, lire en ligne, consulté le )
- Laurence Arbibe et al., « An injected bacterial effector targets chromatin access for transcription factor NF-kappaB to alter transcription of host genes involved in immune responses », Nature Immunology, vol. 8, no 1, , p. 47–56 (ISSN 1529-2908, PMID 17159983, DOI 10.1038/ni1423, lire en ligne, consulté le )
- Meghan E. Pennini et al., « Histone methylation by NUE, a novel nuclear effector of the intracellular pathogen Chlamydia trachomatis », PLoS pathogens, vol. 6, no 7, , e1000995 (ISSN 1553-7374, PMID 20657819, PMCID 2904774, DOI 10.1371/journal.ppat.1000995, lire en ligne, consulté le )
- (en) Monica Rolando et al., « Legionella pneumophila Effector RomA Uniquely Modifies Host Chromatin to Repress Gene Expression and Promote Intracellular Bacterial Replication », Cell Host & Microbe, vol. 13, no 4, , p. 395–405 (DOI 10.1016/j.chom.2013.03.004, lire en ligne, consulté le )
- (en) Ting Li et al., « SET‐domain bacterial effectors target heterochromatin protein 1 to activate host rDNA transcription », EMBO reports, vol. 14, no 8, , p. 733–740 (ISSN 1469-221X et 1469-3178, PMID 23797873, PMCID PMC3736128, DOI 10.1038/embor.2013.86, lire en ligne, consulté le )
- Alice Lebreton et al., « A bacterial protein targets the BAHD1 chromatin complex to stimulate type III interferon response », Science (New York, N.Y.), vol. 331, no 6022, , p. 1319–1321 (ISSN 1095-9203, PMID 21252314, DOI 10.1126/science.1200120, lire en ligne, consulté le )
- (en) Kristen E. Rennoll-Bankert et al., « Chromatin-bound bacterial effector ankyrin A recruits histone deacetylase 1 and modifies host gene expression: AnkA recruits HDAC1 to modify CYBB expression », Cellular Microbiology, vol. 17, no 11, , p. 1640–1652 (PMID 25996657, PMCID PMC5845759, DOI 10.1111/cmi.12461, lire en ligne, consulté le )
- (en) Tierra R. Farris et al., « Ehrlichia chaffeensis TRP32 Is a Nucleomodulin That Directly Regulates Expression of Host Genes Governing Differentiation and Proliferation », Infection and Immunity, vol. 84, no 11, , p. 3182–3194 (ISSN 0019-9567 et 1098-5522, PMID 27572329, PMCID PMC5067751, DOI 10.1128/IAI.00657-16, lire en ligne, consulté le )
- (en) Shubhajit Mitra et al., « Ehrlichia chaffeensis TRP120 Effector Targets and Recruits Host Polycomb Group Proteins for Degradation To Promote Intracellular Infection », Infection and Immunity, vol. 86, no 4, , e00845–17, /iai/86/4/e00845–17.atom (ISSN 0019-9567 et 1098-5522, PMID 29358333, PMCID PMC5865042, DOI 10.1128/IAI.00845-17, lire en ligne, consulté le )
- (en) Imtiyaz Yaseen et al., « Mycobacteria modulate host epigenetic machinery by Rv1988 methylation of a non-tail arginine of histone H3 », Nature Communications, vol. 6, no 1, , p. 8922 (ISSN 2041-1723, DOI 10.1038/ncomms9922, lire en ligne, consulté le )
- (en) Sabine Kay et al., « A Bacterial Effector Acts as a Plant Transcription Factor and Induces a Cell Size Regulator », Science, vol. 318, no 5850, , p. 648–651 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1144956, lire en ligne, consulté le )
- (en) Patrick Römer et al., « Plant Pathogen Recognition Mediated by Promoter Activation of the Pepper Bs3 Resistance Gene », Science, vol. 318, no 5850, , p. 645–648 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1144958, lire en ligne, consulté le )
- (en) Takahito Toyotome et al., « Shigella Protein IpaH 9.8 Is Secreted from Bacteria within Mammalian Cells and Transported to the Nucleus », Journal of Biological Chemistry, vol. 276, no 34, , p. 32071–32079 (ISSN 0021-9258 et 1083-351X, DOI 10.1074/jbc.M101882200, lire en ligne, consulté le )
- (en) Jun Okuda et al., « Shigella effector IpaH9.8 binds to a splicing factor U2AF35 to modulate host immune responses », Biochemical and Biophysical Research Communications, vol. 333, no 2, , p. 531–539 (DOI 10.1016/j.bbrc.2005.05.145, lire en ligne, consulté le )
- (en) Frédéric Taieb et al., « Cycle Inhibiting Factors (Cifs): Cyclomodulins That Usurp the Ubiquitin-Dependent Degradation Pathway of Host Cells », Toxins, vol. 3, no 4, , p. 356–368 (ISSN 2072-6651, PMID 22069713, PMCID PMC3202828, DOI 10.3390/toxins3040356, lire en ligne, consulté le )
- (en) Stefanie Norkowski et al., « Bacterial LPX motif-harboring virulence factors constitute a species-spanning family of cell-penetrating effectors », Cellular and Molecular Life Sciences, vol. 75, no 12, , p. 2273–2289 (ISSN 1420-682X et 1420-9071, DOI 10.1007/s00018-017-2733-4, lire en ligne, consulté le )
- (en) Michael Connor et al., « Customizing Host Chromatin: a Bacterial Tale », Microbiology Spectrum, vol. 7, no 2, (ISSN 2165-0497, DOI 10.1128/microbiolspec.BAI-0015-2019, lire en ligne, consulté le )
- Hélène Bierne, « Cross Talk Between Bacteria and the Host Epigenetic Machinery », dans Epigenetics of Infectious Diseases, Springer International Publishing, (ISBN 978-3-319-55019-0, DOI 10.1007/978-3-319-55021-3_6, lire en ligne), p. 113–158
- Pawel Pelczar et al., « Agrobacterium proteins VirD2 and VirE2 mediate precise integration of synthetic T-DNA complexes in mammalian cells », EMBO Reports, vol. 5, no 6, , p. 632–637 (ISSN 1469-221X, PMID 15153934, PMCID 1299075, DOI 10.1038/sj.embor.7400165, lire en ligne, consulté le )
- Alice Lebreton et al., « Structural basis for the inhibition of the chromatin repressor BAHD1 by the bacterial nucleomodulin LntA », mBio, vol. 5, no 1, , e00775–00713 (ISSN 2150-7511, PMID 24449750, PMCID 3903274, DOI 10.1128/mBio.00775-13, lire en ligne, consulté le )
- (en) Monica Rolando et al., « Legionella pneumophila Effector RomA Uniquely Modifies Host Chromatin to Repress Gene Expression and Promote Intracellular Bacterial Replication », Cell Host & Microbe, vol. 13, no 4, , p. 395–405 (DOI 10.1016/j.chom.2013.03.004, lire en ligne, consulté le )
- (en) Ting Li et al., « SET‐domain bacterial effectors target heterochromatin protein 1 to activate host rDNA transcription », EMBO reports, vol. 14, no 8, , p. 733–740 (ISSN 1469-221X et 1469-3178, PMID 23797873, PMCID PMC3736128, DOI 10.1038/embor.2013.86, lire en ligne, consulté le )