ADN-T
L'ADN-T ou ADN de transfert[1], est la région d'ADN transférée dans la plante après infection par les bactéries pathogènes des végétaux, Agrobacterium tumefaciens ou Agrobacterium rhizogenes qui sont responsables de la galle du collet.

Infection
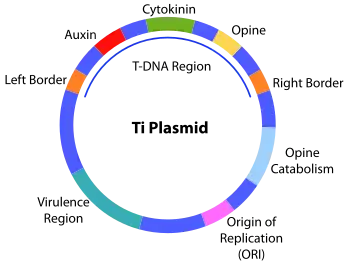
L’ADN-T est contenu dans le plasmide Ti (et -Ri), lors de l’infection de blessures par Agrobacterium, l’ADN-T va être injecté dans la plante et va s’intégrer au génome nucléaire des cellules végétales. Les gènes portés par l'ADN-T s'expriment alors et conduisent à une multiplication anarchique des cellules végétales, d'où formation de la tumeur (galle du collet)[2].
Organisation génique
l’ADN-T, comprend 20 Kb et code des enzymes permettant la synthèse d’opines et de phytohormones permettant la reprogrammation des cellules végétales en tumeur. L’ADN-T est délimité par de deux répétitions (repeat) de 25 bases permettant l’initiation et la terminaison de son transfert.
Utilisation en tant qu’outil
La transformation de cellules végétales par l’ADN-T (via Agrobacterium tumefaciens) est très largement utilisée. Les régions codantes des enzymes contenues dans l’ADN-T peuvent être remplacées par une séquence d’intérêt pouvant être ainsi insérée de manière stable dans le génome végétal. Cette utilisation permet la création de plante transgénique[3].
L’ADN-T peut être également utilisé pour générer des insertions aléatoires dans les génomes végétaux, afin d’obtenir des mutations de gènes. C’est une méthode très utilisée notamment pour étudier la plante modèle Arabidopsis thaliana (T-DNA databases).
Utilisation en biotechnologie
Le transfert d’ADNT à base d’agrobactéries est largement utilisé comme outil de biotechnologie. Depuis plus de deux décennies, Agrobacterium tumefaciens est exploité pour introduire des gènes dans les plantes pour la recherche fondamentale ainsi que pour la production commerciale de cultures transgéniques[4]. En génie génétique, les gènes tumeur-promotion et opine-synthèse sont enlevés de l’ADN T et remplacés par un gène d’intérêt et/ou un marqueur de sélection, qui est nécessaire pour établir quels plants ont été transformés avec succès. Des exemples de marqueurs de sélection incluent la phosphotransférase de néomycine, la phosphotransférase d’hygromycine B (qui phosphorylatent les antibiotiques) et l’acétyltransférase de phosphinothricine (qui acétylate et désactive la phosphinothricine, un inhibiteur puissant de la synthétase de glutamine) ou des formulations d’herbicide telles que Basta ou Bialophos[5]. Un autre système de sélection qui peut être employé est l’utilisation des marqueurs métaboliques tels que l’isomérase de phospho-mannose[6]. Agrobacterium est alors employé comme vecteur pour transférer l’ADN-T machiné dans les cellules végétales où il s’intègre dans le génome végétal. Cette méthode peut être utilisée pour générer des plantes transgéniques porteuses d’un gène étranger. Agrobacterium tumefaciens est capable de transférer efficacement l’ADN étranger aux plantes monocotylédones et dicotylédones tout en prenant compte des facteurs d’importance critique comme le génotype des plantes, les types et les âges des tissus inoculés, le type de vecteurs, les souches d’Agrobacterium, les gènes marqueurs de sélection et les agents sélectifs, et diverses conditions de culture tissulaire[7].
La même procédure de transfert de l'ADN-T peut être utilisée pour perturber les gènes par mutagenèse insertionnelle[8]. Non seulement la séquence insérée d'ADN-T crée une mutation mais son insertion "marque"[9] également un gène affecté, permettant ainsi son isolement en tant que séquence de flanc de l'ADN-T. Un gène reporter peut être lié à l’extrémité droite de l’ADN-T à transformer avec un replicon plasmide et un antibiotique sélectionnable (comme l’hygromycine)-gène de résistance et peut expliciter environ 30% de l’efficacité moyenne ayant réussi l'insertion d'ADN-T induisant des fusions gènes dans Arabidopsis thaliana.[10]
La génétique inverse consiste à tester la fonction présumée d’un gène connu en le perturbant, puis en recherchant l’effet de cette mutation induite sur le phénotype de l’organisme. Le marquage mutagène d'ADN-T implique le criblage des populations par mutations insertionnelles d'ADN-T. Les collections de mutations connues de l’ADN T fournissent des ressources pour étudier les fonctions des gènes individuels, telles que développées pour la plante modèle Arabidopsis thaliana.[11] Les exemples de mutations d’insertion d'ADN-T dans Arabidopsis thaliana incluent ceux associés avec beaucoup de classes de phénotypes comprenant des semis-mortels, des variantes de taille, des variantes de pigment, des embryo-défectueux, la fertilité réduite, et les usines morphologiquement ou physiologiquement aberrantes[12].
Notes et références
- À ne pas confondre avec l'ARN de transfert.
- (en) Ziemienowicz A, « Odyssey of agrobacterium T-DNA », Acta Biochim. Pol., vol. 48, no 3, , p. 623–35 (PMID 11833771)
- Zambryski P. et al. 1983. Ti plasmid vector for introduction of DNA into plant cells without alteration of their normal regeneration capacity. EMBO J. 2:2143-2150.
- Heiko Oltmanns, Bronwyn Frame, Lan-Ying Lee et Susan Johnson, « Generation of Backbone-Free, Low Transgene Copy Plants by Launching T-DNA from the Agrobacterium Chromosome1[W][OA] », Plant Physiology, vol. 152, no 3, , p. 1158–1166 (ISSN 0032-0889, PMID 20023148, PMCID 2832237, DOI 10.1104/pp.109.148585, lire en ligne, consulté le )
- Lan-Ying Lee et Stanton B. Gelvin, « T-DNA Binary Vectors and Systems », Plant Physiology, vol. 146, no 2, , p. 325–332 (ISSN 0032-0889, PMID 18250230, PMCID 2245830, DOI 10.1104/pp.107.113001, lire en ligne, consulté le )
- (en) Rebecca Todd et Brian W. Tague, « Phosphomannose isomerase: A versatile selectable marker forArabidopsis thaliana germ-line transformation », Plant Molecular Biology Reporter, vol. 19, no 4, , p. 307–319 (ISSN 1572-9818, DOI 10.1007/BF02772829, lire en ligne, consulté le )
- (en) Yukoh Hiei, Toshihiko Komari et Tomoaki Kubo, « Transformation of rice mediated by Agrobacterium tumefaciens », Plant Molecular Biology, vol. 35, no 1, , p. 205–218 (ISSN 1573-5028, DOI 10.1023/A:1005847615493, lire en ligne, consulté le )
- P J Krysan, J C Young et M R Sussman, « T-DNA as an insertional mutagen in Arabidopsis. », The Plant Cell, vol. 11, no 12, , p. 2283–2290 (ISSN 1040-4651, PMID 10590158, lire en ligne, consulté le )
- Yao-Guang Liu, Yumiko Shirano, Hidehiro Fukaki et Yukihiro Yanai, « Complementation of plant mutants with large genomic DNA fragments by a transformation-competent artificial chromosome vector accelerates positional cloning », Proceedings of the National Academy of Sciences of the United States of America, vol. 96, no 11, , p. 6535–6540 (ISSN 0027-8424, PMID 10339623, lire en ligne, consulté le )
- C Koncz, N Martini, R Mayerhofer et Z Koncz-Kalman, « High-frequency T-DNA-mediated gene tagging in plants. », Proceedings of the National Academy of Sciences of the United States of America, vol. 86, no 21, , p. 8467–8471 (ISSN 0027-8424, PMID 2554318, lire en ligne, consulté le )
- Anis Ben-Amar, Samia Daldoul, Götz M. Reustle et Gabriele Krczal, « Reverse Genetics and High Throughput Sequencing Methodologies for Plant Functional Genomics », Current Genomics, vol. 17, no 6, , p. 460–475 (ISSN 1389-2029, PMID 28217003, PMCID 5282599, DOI 10.2174/1389202917666160520102827, lire en ligne, consulté le )
- (en) Kenneth A. Feldmann, « T-DNA insertion mutagenesis in Arabidopsis: mutational spectrum », The Plant Journal, vol. 1, no 1, , p. 71–82 (ISSN 1365-313X, DOI 10.1111/j.1365-313X.1991.00071.x, lire en ligne, consulté le )