Nitrobenzaldéhyde
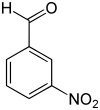
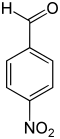
Le nitrobenzaldéhyde est un composé aromatique de formule C7H5NO3. Il est constitué d'un cycle benzénique substitué par un groupe formyle (benzaldéhyde) et un groupe nitro. Comme tous les benzènes disubstitués, il existe sous la forme de trois isomères structuraux, les composés ortho, méta et para, selon la position relative des deux substituants sur le cycle.
Propriétés
| Nitrobenzaldéhyde | |||
| Nom | 2-nitrobenzaldéhyde | 3-nitrobenzaldéhyde | 4-nitrobenzaldéhyde |
| Autre nom | orthonitrobenzaldéhyde o-nitrobenzaldéhyde |
métanitrobenzaldéhyde m-nitrobenzaldéhyde |
paranitrobenzaldéhyde p-nitrobenzaldéhyde |
| Représentation |  |
 |
 |
| Numéro CAS | |||
| PubChem | 11101 | 7449 | 541 |
| Formule brute | C7H5NO3 | ||
| Masse molaire | 151,12 g·mol−1 | ||
| État | solide | ||
| Apparence | poudre cristalline jaune clair à l'odeur caractéristique[1] |
poudre cristalline jaune à l'odeur d'amande amère[2] |
poudre cristalline jaune à l'odeur caractéristique[3] |
| Masse volumique (20 °C) |
1,27 g·cm-3[2] | 1,496 g·cm-3[3] | |
| Point de fusion | 41 à 43 °C[1] | vers 55 °C[2] | 103 à 106 °C[3] |
| Point d'ébullition | 156 °C (20 hPa)[1] | >285 °C[2] 164 °C (31 hPa) |
|
| Point d'auto-inflammation | 200 °C[1] | vers 280 °C[2] | |
| LogP | 1,74[1] | 1,47[2] | 1,56[3] |
| Solubilité dans l'eau |
pratiquement insoluble[1] | 1,6 g·l-1 (25 °C)[2] | 2,34 g·l-1 (25 °C)[3] |
| SGH[1] - [2] - [3] |
 Attention |
  Attention |
 Attention |
| Phrase H et P[1] - [2] - [3] | H302, H315, H319 et H335 |
H302 et H411 |
H317, H319 et H412 |
| P261 et P305+P351+P338 |
P273 |
P261, P280 et P302+P352 P305+P351+P338 | |
Les nitrobenzaldéhydes sont des solides cristallins légèrement jaunes, dont certains ont une odeur d'amande amère. Le 4-nitrobenzaldéhyde, qui présente la plus grande symétrie, a le point de fusion le plus élevé.
Par une réaction de Cannizzaro en milieu basique, les nitrobenzaldéhydes se dismutent en acides nitrobenzoïques et en alcools nitrobenzyliques.
Synthèse
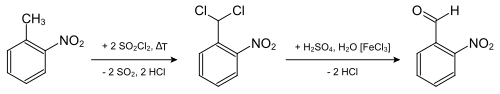
- Le 2-nitrotoluène est chloré par le chlorure de thionyle à la chaleur ; le dichlorure de 2-nitrobenzylidène qui en résulte est saponifié, produisant du 2-nitrobenzaldéhyde :
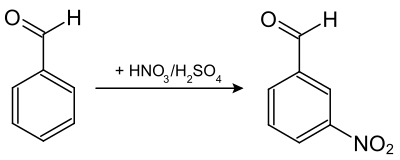
- Le 3-nitrobenzaldéhyde est obtenu à partir du benzaldéhyde, par réaction avec de l'acide nitrique fumant en présence d'acide sulfurique concentré[4] :
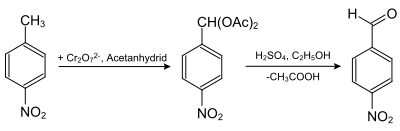
- Le 4-nitrobenzaldéhyde est obtenu à partir du 4-nitrotoluène, par oxydation à l'oxyde de chrome(VI) dans l'anhydride acétique. Le diacétate de 4-nitrobenzal qui en résulte est hydrolysé avec de l'acide sulfurique dans de l'éthanol aqueux[5] :
Notes et références
- Entrée « 2-Nitrobenzaldehyde » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 31 mars 2020 (JavaScript nécessaire).
- Entrée « 3-Nitrobenzaldehyde » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 31 mars 2020 (JavaScript nécessaire).
- Entrée « 4-Nitrobenzaldehyde » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 31 mars 2020 (JavaScript nécessaire).
- Uni Hamburg: 3-Nitrobenzaldehyd, Versuchsvorschrift (PDF; 24 kB).
- S. V. Lieberman and Ralph Connor, p-Nitrobenzaldehyde, Org. Synth. 18, coll. « vol. 2 », , 61 p., p. 441
- Helmut Schmidt: „Indigo – 100 Jahre industrielle Synthese“, in: Chemie in unserer Zeit, 1997, 31 (3), S. 121–128; doi:10.1002/ciuz.19970310304.
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.