Nematostella
Nematostella est une anémone de mer appartenant à l'embranchement des Cnidaria, elle est retrouvée aux États-Unis, au Canada et en Angleterre[1]. En biologie évolutive du développement, Nematostella est considérée comme un organisme modèle, sa culture et la manipulation de ses embryons sont faciles et cela nous permet de comprendre par comparaison, le processus développemental et l'évolution des caractéristiques des bilatériens[2]. Ces derniers proviennent tous d'un ancêtre commun, il y a donc un maintien de quelques gènes en commun ainsi que des voies métaboliques développementales durant l'évolution. Son génome a été séquencé[3]. L'apomorphie morphologique de Nematostella est dû à la présence de nématosomes.
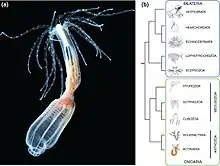

Description de Nematostella
Cycle de vie
Nematostella vit dans des estuaires et est donc exposée à des changements de salinité et de température. Celle-ci a une tolérance physiologique pour pouvoir vivre dans ces environnements instables. Elle est dioïque, a des sexes séparés pour faire la reproduction sexuée, et peut aussi faire la multiplication asexuée (bourgeonnement). Le cycle de vie de Nematostella dure environ 12 semaines en culture[4]. Les zygotes subissent une série de clivages pour former un blastula. Tout d'abord, les embryons passent par la phase de gastrulation en formant une invagination (Figure 2 (a)). Puis, des planules ciliées émergent de l'œuf, elles s'allongent et forment le premier mésentère avec quatre bourgeons de tentacules. Ils cessent d'être des nageurs libres et deviennent des anémones juvéniles (polype juvenile) (Figure 2(b)). Ensuite, des tentacules supplémentaires ainsi que huit macrocnèmes se développent. Les individus peuvent atteindre leur maturité sexuelle en 2 ou 3 mois[5].
Morphologie
Nematostella est un animal diploblastiques à morphologie simple, c'est-à-dire qu'elle est formée de deux couches germinales, un endoderme interne bifonctionnel, ainsi qu'un ectoderme externe (figure 2 (a)). Elle possède un intestin en forme de sac avec une seule ouverture orale qui correspond au site de gastrulation [6] (figure 2 (b)). Elle a à l'une de ses extrémités un bulbe basal et est tituée d'une colonne contractile qui lui permet de s'agripper. La bouche adulte est entourée de 16 tentacules [7] (figure 1 (a)). Elles ont un pharynx et huit structures de mésentère radialement répétées le long de l'axe oral (figure 2 (b)). Les mésentères sont titués de gonades, de cnidocytes et de cellules myoépithéales qui permettent à l'animal de se contracter rapidement le long de l'axe longitudinal[8].
Modèle développemental
Bien qu'elle ne soit pas morphologiquement complexe, Nematostella possède un répertoire génomique complexe qui pourrait lier l'organisation axiale des anthozoaires à celle des bilatériens[9]. Presque toutes les familles de gènes présentes chez les bilatériens ont été trouvées chez Nematostella. Les vertébrés et le Nematostella sont plus semblables comparés aux autres animaux modèles d'ecdysozoa (Drosophiles et nematodes)[10]. En effet, Le génome complexe de Nematostella comprend les ligands Wnt présents chez les deutérostomes bilatéraux[11]. De plus, il y avait une conservation chromosomale considérable et une conservation élevée des limites intron-exon entre les génomes des cnidaires et ceux des vertébrés[12]. Chez Nematostella, l'un des cinq gènes hox antérieurs est exprimé dans le pharynx au stade des planules[13], alors que trois autres gènes hox antérieurs sont exprimés dans un domaine unilatéral de l'endoderme. Parmi les deux gènes hox postérieurs, l'un est exprimé au niveau du pôle aboral et l'autre dans un domaine endodermique unilatéral de la même extension orale-aborale que les trois gènes hox antérieurs[14]. Nematostella a un groupe de sept gènes comprenant trois gènes Hox et quatre gènes apparentés à Hox et un groupe ParaHox séparé à deux gènes[15]. Il y a sept gènes Hox dans Nematostella appartenant aux sous-familles Hox1, Hox2 et Hox9-14, et ils sont exprimés dans trois domaines distincts qui couvrent la totalité de l'axe du corps. Ceci prouve l'existence d'un «code Hox» rudimentaire. Les gènes Hox sont également exprimés dans des domaines entremêlés le long de l'axe secondaire et ils pourraient jouer un rôle dans la structuration de cet axe du corps. Les preuves phylogénétique suggèrent que les clusters de gènes Hox et ParaHox peuvent s'être formés à travers une série de duplications de gènes en tandem. La formation de son endoderme bifonctionnel donnerait naissance à l'endomésoderme des bilatériens[2].
Écologie et distribution
Nematostella se nourrit de petits mollusques et crustacés, de larves de chironomes, de nématodes, de copepodes, d'ostracodes, de polychètes. Son prédateur est la crevette Palaemonetes pugio[16].
Espèces de Nematostella [17] - [18]
Nematostella vectensis (Stephenso, 1935)
Développement neural chez Nematostella vectensis (N. Vectensis):
La différenciation neurale chez N. vectensis est modulée selon l'activité du gène Notch. Ce gène agit selon une voie de signalisation précise, nommée la signalisation Notch. La signalisation Notch a été conservée chez les animaux bilatériens et elle régule la différenciation cellulaire chez ceux qui la possèdent. En effet, elle est impliquée dans la différenciation cellulaire de plusieurs types de tissus chez les bilatériens, tels que les tissus nerveux, sanguins, épidermiques, musculaires et osseux.
Évolutivement, il est spéculé que la signalisation Notch ait émergé dans le but de réguler la différenciation cellulaire chez les métazoaires. En effet, l'émergence d'animaux multicellulaires possédant des cellules spécialisées nécessite un mécanisme dont le but est de réguler la différenciation de la cellule, c'est-à-dire de déterminer si la cellule se spécialise ou si elle reste pluripotente. La différenciation cellulaire débute dans les premiers stades de la gastrulation durant le développement de Nematostella et se poursuit dans les stades embryonnaires et larvaires. La signalisation Notch est davantage retrouvée dans les tissus susceptibles de subir un épisode de différenciation cellulaire.
Le rôle de la signalisation Notch est reconnu comme étant de réguler la différenciation cellulaire durant la neurogenèse, c'est-à-dire le processus de formation d'un neurone, chez les bilatériens. Le gène Notch inhibe la neurogenèse en réprimant l'expression des facteurs de transcription des gènes pro-neuraux. Le gène Notch inhibe fortement l'expression des gènes agissant dans le processus de différenciation neurale. En effet, l'activité de Notch chez N. vectensis démontre que ce gène régule la compétence des cellules à répondre à une variété d'indices qui dictent la différenciation des cellules chez l'espèce. Ainsi, lorsque Notch est abondamment exprimé, la différenciation cellulaire est réprimée et le contraire s'applique lorsque Notch est très peu exprimé. Autrement dit, durant le processus de neurogenèse chez les vertébrés, une concentration élevée du gène Notch chez les cellules souches neurales font que ces dernières conservent leur forme et leur rôle basal. Contrairement à ceci, lorsque la concentration de Notch est faible, les cellules souches peuvent se différencier en devenant des neurones matures. De plus, les cellules souches, restées indifférenciées par l'effet que l'activité de Notch ont sur elles, peuvent réagir face à des signaux inductifs provenant de l'environnement. Ces signaux pourraient être susceptibles de moduler le processus de différenciation de ces cellules.
Plusieurs chercheurs ayant effectué des analyses génomiques des composantes de bases du gène Notch suggèrent que la signalisation Notch aurait évolué spécifiquement dans la lignée des métazoaires et que tous les clades d'animaux possèdent des homologues de Notch. La voie de signalisation du gène Notch peut réguler la différenciation des cellules neurales selon deux mécanismes : la voie canonique ou non-canonique. Évolutivement, les composantes essentielles de la voie canonique de la signalisation Notch ont apparu en même temps que l'émergence de l'ancêtre commun des cnidaires bilatériens. Ainsi, l'origine de la signalisation de Notch a été longtemps questionnée quant au type de voie l'activant, c'est-à-dire laquelle entre canonique et non-canonique représenterait la forme ancestrale du mécanisme. Pour déterminer cela, les chercheurs ont utilisé l'anémone de mer Nematostella vectensis.
Il a été prouvé que la voie non-canonique de la signalisation de Notch chez l'anémone de mer appartenant à l'embranchement des cnidaires (N. vectensis) inhibe grandement la différenciation cellulaire durant le développement. Puisque le rôle de Notch a été grandement conservé à travers les lignées et que les composantes spécifiques de ce gène n'ont évolué que chez les métazoaires, il est fortement probable que Notch régule la différenciation chez tous les métazoaires. Une étude démontre que la signalisation de Notch se fait selon la voie non-canonique et ce, grâce à la modification de la concentration des gènes spécifiques à une voie (canonique ou non-canonique). De plus, la distribution phylogénétique des composantes de la voie canonique de la signalisation Notch démontre l'absence d'une signalisation à voie canonique chez les cnidaires. Donc, il a été proposé que la signalisation Notch à voie non-canonique est la forme ancestrale du fonctionnement du gène Notch et qu'elle aurait servi à réguler la différenciation cellulaire chez l'ancêtre des cnidaires bilatériens. Ceci servirait de preuve tel que le rôle de Notch aurait évolué avant l'émergence de l'ancêtre commun de tous les animaux bilatériens.
Le marqueur génétique responsable de la régulation de la neurogenèse embryonnaire chez N. vectensis est ashA, plus connu sous le nom NvashA, où Nv réfère à l'espèce en question. En effet, l'activité de Notch chez cette anémone de mer inhibe l'expression du gène NvashA. Cette inhibition réprime l'expression de nombreux marqueurs de différenciation qui dépendent de NvashA pour leur bon fonctionnement. Sans ce marqueur, le développement neural de N. vectensis est fortement réduit[19].
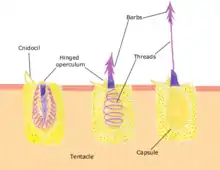
Développement du cnidocyte chez N. vectensis:
Les cnidocytes sont des structures spécifiques aux cnidaires; elles sont utilisées afin de capturer des proies, comme moyen de défense et de locomotion. Le développement de cette structure est régulé par les gènes Pax. Auparavant, les cnidocytes étaient considérés tels des neurones, puisqu'ils se différenciaient à partir des mêmes cellules promotrices que ceux-ci. Ainsi, les gènes Pax auraient un rôle ancestral de spécification neurale chez les métazoaires.
Les gènes Pax composent une famille de facteurs de transcription responsables de la régulation de plusieurs aspects de la morphogenèse développementale, et plus particulièrement du développement de structures sensorielles dans la couche ectodermique. La diversification de ce gène aurait grandement eu lieu à partir de l'ancêtre commun des cnidaires bilatériens. Cette famille de gènes aurait évolué dans la lignée des métazoaires, mais elle aurait existé dans plusieurs autres lignées avant cela. N. vectensis contient plusieurs orthologues de Pax, dont la plupart sont exprimés dès les premières étapes de l'embryogénèse.
Parmi les orthologues de Pax présents chez N. vectensis se trouve le gène PaxA. En effet, PaxA a un rôle critique dans le développement des cnidocytes chez cette anémone de mer; sans ce gène, le développement du cnidocyte n'aurait pas lieu. D'ailleurs, les chercheurs ont déterminé que sans PaxA, il y a régulation négative de l'expression de plusieurs gènes reliés au développement du cnidocyte, tel que le facteur de transcription Mef2. De plus, PaxA est modulé selon l'activité du gène promoteur neural SoxB2, sans qui il n'y aurait ni expression de PaxA, ni celle de Mef2 ni celle de multiples gènes spécifiques au développement du cnidocyte. Il est spéculé que le processus de formation du cnidocyte serait dû à l'expression de cellules contenant SoxB2 dans leur génome; ces dernières se diviseraient pour donner naissance à des cnidocytes exprimant le gène PaxA.
Les facteurs de transcription Sox sont reconnus pour remplir plusieurs rôles dans le développement et le maintien de la spécificité des cellules. Récemment, une étude sur la N. vectensis a révélé que le facteur de transcription SoxB2 (un orthologue des gènes SoxB des bilatériens) est exprimé chez la population de cellules promotrices des neurones et des cnidocytes. Le facteur de transcription Mef2 est également impliqué dans la formation du cnidocyte chez cette anémone de mer[20].
Nematostella nathorstii (Carlgren, 1921)
Nematostella polaris (Carlgren, 1921)
Voir aussi
Notes et références
- (en) Cadet Hand et Kevin R. Uhlinger, « The unique, widely distributed, estuarine sea anemone, Nematostella vectensis Stephenson: A review, new facts, and questions », Estuaries, 17:501,
- (en) Michael J. Layden, Fabian Rentzsch and Eric Röttinger, « The rise of the starlet sea anemone Nematostella vectensis as a model system to investigate development and regeneration », Wiley Interdiscip Rev Dev Biol. 5(4), 408-428. doi:10.1002/wdev.222, 2016 jul-aug
- (en) Putnam NH, Srivastava M, Hellsten U, Dirks B, Chapman J et al.,, « Sea anemone genome reveals ancestral eumetazoan gene repertoire and genomic organization. », Science Vol. 317, Issue 5834, pp. 86-94,
- (en) Cadet Hand et Kevin R. Uhlinger, « The Culture, Sexual and Asexual Reproduction, and Growth of the Sea Anemone Nematostella vectensis », Biol. Bull. 182: 169-176., avril, 1992
- (en) Jens H. Fritzenwanker, Grigory Genikhovich, Yulia Kraus et Ulrich Technau, « Early development and axis specification in the sea anemone Nematostella vectensis », Developmental Biology 310. 264–279,
- (en) Patricia N. Lee, Shalika Kumburegama, Heather Q. Marlow, Mark Q. Martindale et Athula H. Wikramanayake, « Asymmetric developmental potential along the animal–vegetal axis in the anthozoan cnidarian, Nematostella vectensis, is mediated by Dishevelled », Developmental Biology 310. 169–186,
- (en) Ashleigh E. Fritz, Aissam Ikmi, Christopher Seidel, Ariel Paulson et Matthew C. Gibson, « Mechanisms of tentacle morphogenesis in the sea anemone Nematostella vectensis », Development 140, 2212-2223. doi:10.1242/dev.088260 © 2013,
- (en) Richard P. Tucker, Bradley Shibata et Thomas N. Blankenship, « Ultrastructure of the mesoglea of the sea anemone Nematostella vectensis (Edwardsiidae) », Invertebrate Biology. 130(1): 11–24.,
- (en) Joseph F. Ryan, Maureen E. Mazza, Kevin Pang, David Q. Matus, Andreas D. Baxevanis, Mark Q. Martindale et John R. Finnerty, « Pre-Bilaterian Origins of the Hox Cluster and the Hox Code: Evidence from the Sea Anemone, Nematostella vectensis », PLoS ONE 2(1): e153. doi:10.1371/journal.pone.000015,
- (en) Sullivan JC et Finnerty JR., « A surprising abundance of human disease genes in a simple "basal" animal, the starlet sea anemone (Nematostella vectensis). », Genome; 50(7):689-92.,
- (en) Kusserow A, Pang K, Sturm C, Hrouda M, Lentfer J, Schmidt HA, Technau U, von Haeseler A, Hobmayer B, Martindale MQ et Holstein TW., « Unexpected complexity of the Wnt gene family in a sea anemone. », Nature. 13;433(7022):156-60.,
- (en) Putnam NH, Srivastava M, Hellsten U, Dirks B, Chapman J, Salamov A, Terry A, Shapiro H, Lindquist E, Kapitonov VV, Jurka J, Genikhovich G, Grigoriev IV, Lucas SM, Steele RE, Finnerty JR, Technau U, Martindale MQ et Rokhsar DS., « Sea anemone genome reveals ancestral eumetazoan gene repertoire and genomic organization. », Science. 6;317(5834):86-94.,
- (en) Finnerty JR, Pang K, Burton P, Paulson D et Martindale MQ., « Origins of bilateral symmetry: Hox and dpp expression in a sea anemone. », Science. 28;304(5675):1335-7,
- (en) Ryan JF, Mazza ME, Pang K, Matus DQ, Baxevanis AD, Martindale MQ et Finnerty JR., « Pre-bilaterian origins of the Hox cluster and the Hox code: evidence from the sea anemone, Nematostella vectensis. », PLoS One. 24;2(1):e153.,
- Chourrout D, Delsuc F, Chourrout P, Edvardsen RB, Rentzsch F, et al., « Minimal ProtoHox cluster inferred from bilaterian and cnidarian Hox complements. », Nature. 10;442(7103):684-7.,
- (en) R.T.Kneib, « Predation and disturbance by grass shrimp, Palaemonetespugio Holthuis, in soft-substratum benthic invertebrate assemblages », Journal of Experimental Marine Biology and Ecology Volume 93, Issues 1–2, Pages 91-102,
- (en) P. J. Hayward et J. S. Ryland, The Marine Fauna of the British Isles and North-West Europe : Molluscs to Chordates, , 688 Pages (ISBN 978-0-19-857356-2, lire en ligne), p. 4. Cnidaria, P.F.S. Cornelius, R.L. Manuel, and J.S. Ryland
- (en) « WoRMS (World Register of Marine Species) taxon details »
- Michael J. Layden et Mark Q. Martindale, « Non-canonical Notch signaling represents an ancestral mechanism to regulate neural differentiation », EvoDevo, vol. 5, , p. 30 (ISSN 2041-9139, PMID 25705370, PMCID 4335385, DOI 10.1186/2041-9139-5-30, lire en ligne, consulté le )
- Leslie S. Babonis et Mark Q. Martindale, « PaxA, but not PaxC, is required for cnidocyte development in the sea anemone Nematostella vectensis », EvoDevo, vol. 8, , p. 14 (ISSN 2041-9139, PMID 28878874, PMCID 5584322, DOI 10.1186/s13227-017-0077-7, lire en ligne, consulté le )