Minoxidil
Le minoxidil est un médicament vasodilatateur et antihypertenseur initialement utilisé pour soigner l’hypertension artérielle. Il n’est administré aujourd’hui qu’après échec des autres antihypertenseurs.
| Minoxidil | ||
| ||
 | ||
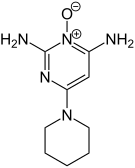
| Structure chimique en 2 dimensions et structure moléculaire en 3 dimensions du Minoxidil | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 6-(1-pipéridinyl)pyrimidine-2,4-diamine 3-oxyde | |
| Synonymes |
6-(1-pipéridinyl)-2,4-pyrimidinediamine 3-oxyde |
|
| No CAS | ||
| No ECHA | 100.048.959 | |
| No CE | 253-874-2 | |
| No RTECS | UV8200000 | |
| Code ATC | C02, D11 | |
| DrugBank | DB00350 | |
| PubChem | 4201 | |
| ChEBI | 6942 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C9H15N5O [Isomères] |
|
| Masse molaire[1] | 209,248 3 ± 0,009 6 g/mol C 51,66 %, H 7,23 %, N 33,47 %, O 7,65 %, |
|
| pKa | 4,61[2] | |
| Propriétés physiques | ||
| T° fusion | 248 °C[2] 262-280 °C (dec.)[3] 272-274 °C (dec.)[4] |
|
| Solubilité | eau : 2,200 g/L[2] | |
| Précautions | ||
| SGH[3] - [4] | ||
  |
||
| Données pharmacocinétiques | ||
| Métabolisme | Métabolisé à 85 % par le foie (glycuronides) | |
| Demi-vie d’élim. | 4 heures | |
| Excrétion |
Voie rénale : 15 % sous forme inchangée et 85 % sous forme de métabolites (glycuronides) |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Il a été constaté au cours de son utilisation qu’un des effets secondaires était une augmentation de la pilosité. Des études ont ensuite permis de confirmer son action positive sur l'alopécie androgénique.
Pour cette dernière utilisation, il est commercialisé sans prescription, uniquement en pharmacie sous la forme d’une lotion capillaire avec de 2 % ou 5 % de minoxidil à utiliser en application locale.
Historique
Fin des années 1950 à 1965 : découverte du minoxidil
À la fin des années 1950, l'entreprise pharmaceutique Américaine the Upjohn Company située au Michigan (devenu plus tard une partie de Monsanto et Pfizer [5] - [6] - [7]), fait des essais en laboratoires pour traiter les ulcères[8]. L'entreprise porte son intérêt sur un composé chimique de synthèse dérivé d'acide barbituriques[9] - [10], lui-même dérivé de la pyrimidine[11] - [7]. Dans les premiers essais utilisant des chiens, le composé chimique ne guérit pas les ulcères, mais s'avère être un puissant vasodilatateur[8] - [7].
L'entreprise synthétise plus de 200 variations dérivées de ce composé chimique, y compris celui qu'elle développera entre 1963 et 1965, qu'elle nommera minoxidil[7] - [8].
1967-1974 : tests cliniques et nouvelle application
En 1967, la FDA (Food and Drug Administration) autorise l'entreprise Upjohn à faire des tests cliniques sur les êtres humains[8] - [7]. L'entreprise engage le docteur Charles Chidsey, professeur agrégé de médecine à l'Université du Colorado School of Medicine de Denver, afin de mener deux études cliniques sur des patients atteints de troubles cardio-vasculaires.
À la fin de l'année 1967/1968, le docteur Chidsey débute sa première étude[7] - [12] - [8].
Entre 1970 et 1971, durant la deuxième étude, le docteur constate que certains patients sous minoxidil présentent comme effet secondaire, un développement pileux sur l'ensemble du corps et un recul d'alopécie androgénétique. Il consulte plusieurs collègues endocrinologues et dermatologues, afin de déterminer son origine. L'origine hormonale étant écartée, il consulte le docteur Guinter Kahn, qui est dermatologue travaillant dans le même établissement, sur une possible utilisation du minoxidil pour un traitement de l'alopécie androgénétique[7] - [13] - [8].
Le docteur Chidsey obtient de l'entreprise Upjohn, une autorisation de délivrer du minoxidil pur au docteur Kahn afin d'étudier cet effet secondaire, avec comme condition de mener ces recherches sous le contrôle du docteur Chidsey[7].
En 1973, après de nombreuses expériences, le docteur Kahn aidé de son collègue le docteur Grant, obtiennent des résultats satisfaisants sur un patient présentant une alopécie, en utilisant une solution de 1 % de minoxidil dissous dans de l'alcool puis appliquée quotidiennement sur le cuir chevelu du patient. Cependant, ils n'informent pas le docteur Chidsey de ces résultats[7] - [8].
En 1974, le docteur Kahn et le docteur Grant essayent de breveter discrètement leurs travaux, mais ils constatent que l'entreprise Upjohn a breveté le même médicament en utilisant la majorité de leurs recherches, et seul le nom du docteur Chidsey est inscrit sur le brevet[7] - [8].
En 1979 : lancement de Loniten
En 1979, pendant que le docteur Kahn bloque le brevet depuis cinq ans, l'entreprise Upjohn obtient une autorisation de mise sur le marché du médicament Loniten, destiné aux malades souffrant d'une hypertension artérielle sévère[14] - [7] - [8].
Le médicament se présente sous forme de comprimés sécables (en tablettes de 2,5 mg et 10 mg) à administrer par voie orale. Il est composé de minoxidil et d’excipients tels que : cellulose microcristaline, amidon de maïs, lactose, stéarate de magnésium, dioxyde de silicium[14].
1986-1988 : lancement de Rogaine
En 1986, la longue bataille administrative qui a duré plusieurs années opposant le docteur Kahn à l'entreprise Upjohn prend fin. Le docteur obtient un accord lui permettant de faire inscrire son nom sur le brevet (US # 4,596,812 Charles A Chidsey, III et Guinter Kahn). Il obtient également de l'entreprise un pourcentage sur les chiffres d'affaires[7] - [8]. Le brevet appartient désormais à l'entreprise Upjohn[7].
Le , une autorisation de mise sur le marché est accordée au médicament Rogaine à 2 % de minoxidil, indiqué dans le traitement de l'alopécie androgénétique chez les hommes[15] - [16] (il sera distribué en Europe sous le nom de Regaine et en France sous les noms de Alostil et Regaine). Le médicament se présente sous forme liquide en flacon de 60 ml et muni d'une pipette graduée. Il est composé de minoxidil, propylène glycol, alcool, eau purifiée.
En 1991, les ventes du médicament Rogaine restent au plus bas depuis 3 ans, les patients ne s'y intéressent pas[17]. L'image de l'entreprise Upjohn est ternie par une affaire sur un autre médicament, pour lequel plus d'une centaine de poursuites sont engagées contre l'entreprise[18] - [17]. Elle entreprend ensuite pour Rogaine la troisième campagne publicitaire la plus chère du monde pour un médicament, à 50 millions de dollars[17]. L'entreprise fait également du démarchage auprès des médecins pour promouvoir son médicament Rogaine, mais la FDA désapprouve ces méthodes[17]. Elle réussit également à obtenir une autorisation pour rendre son médicament Rogaine disponible aux femmes souffrant d'une alopécie androgénétique [16] - [19]. Puis la campagne publicitaire fonctionne et les ventes augmentent de 30 %[17], mais les prix du médicament Rogaine restent élevés[19].
1995-2003 : fusions consécutives
En 1995, l'entreprise Upjohn fusionne avec l'entreprise pharmaceutique Pharmacia AB et devient un grand groupe pharmaceutique mondial dans plusieurs domaines parmi lesquels les médicaments destinés aux êtres humains et aussi ceux destinés aux animaux. Le nouveau groupe prend le nom de Pharmacia & Upjohn[5].
Le , les droits de brevet du médicament Rogaine détenus par l'entreprise Pharmacia & Upjohn ayant expiré, la FDA autorise la mise sur le marché de médicaments génériques de Rogaine[15].
En 1997, l'entreprise Pharmacia & Upjohn réagit à cette perte de brevet en diminuant de moitié les prix de ses médicaments et parvient à obtenir une autorisation de mise sur le marché du médicament Rogaine à 5 % de minoxidil[15] - [16].
En , l'entreprise Pharmacia & Upjohn fusionne avec le géant des produits chimiques Monsanto et devient un leader mondial en produits chimiques et pharmaceutiques. Le nouveau groupe prend le nom de Pharmacia[5].
Le , l'entreprise Pharmacia fusionne avec le géant des produits pharmaceutiques Pfizer Inc, pour ainsi devenir le plus grand groupe pharmaceutique et de produits chimiques du monde. Le nouveau groupe prend le nom de Pfizer[5].
Le , le Lonoten (minoxidil oral pour l’hypertension artérielle) est repris sous la marque Pfizer[20] - [21] - [22](il sera distribué dans d'autres pays dont la France sous le nom de Lonoten par Pfizer[23]). Durant sa période de mise sur le marché de 1979 à 2005, il a été pratiqué des autopsies sur 150 patients décédés de causes diverses et utilisant le Lonoten. Elles n’ont pas permis d’identifier formellement la responsabilité du médicament pour ces décès[14].
2007 : Johnson & Johnson achète Rogaine
En 2007, l'entreprise pharmaceutique Américaine Johnson & Johnson acquiert le médicament Rogaine (elle acquiert également Regaine et Alostil), lors d'un achat d'une partie des médicaments de Pfizer pour 17 milliards de dollars[24] - [25].
En 2008, mise sur le marché du médicament Rogaine en version mousse indiqué chez les hommes[26].
En 2014, mise sur le marché du médicament Rogaine en version mousse indiqué chez les femmes[26].
En France
En 1983 : entrée du minoxidil sur le territoire national
Le , une autorisation de mise sur le marché français est accordée au médicament lonoten[27].
Le , le minoxidil sous toutes ses formes ainsi que ses dérivés, est inscrit sur la liste du tableau A des substances vénéneuses de la médecine humaine par l'arrêté du [28].
Le , une autorisation de mise sur le marché est accordée au médicament Regaine à 2 % de minoxidil pour application locale en flacon de 60 ml (sa commercialisation en France sera arrêtée le )[29], ainsi qu'une autorisation de mise sur le marché du médicament Alostil à 2 % de minoxidil pour application locale en flacon de 60 ml[30].
Le , le minoxidil sous forme topique ainsi que ses dérivés, sont inscrits sur la liste du tableau C des substances vénéneuses de la médecine humaine par l'arrêté du [28].
Le , 4 autorisations de mise sur le marché sont accordées le même jour pour :
- le médicament "Minoxidil Cooper" à 2 % de minoxidil, pour application locale en flacon de 60 ml et distribué par l'entreprise Coopération Pharmaceutique Française[31] ;
- le médicament "Minoxidil Sinclair" à 2 % de minoxidil, pour application locale en flacon de 60 ml et distribué par l'entreprise pharmaceutique Sinclair Pharma France[32] ;
- le médicament "Minoxidil RPG" à 2 % de minoxidil, pour application locale en 30 ampoules de 1 ml chacune et distribué par l'entreprise pharmaceutique Ranbaxy Pharmacie Génériques[33] ;
- le médicament "Minoxidil CS" à 2 % de minoxidil, pour application locale en 30 ampoules de 1 ml chacune et distribué par l'entreprise pharmaceutique CS[34].
1990 : nouvelles législations
Le , une modification des arrêtés du et du est faite par l'arrêté du [35] toujours en vigueur, qui simplifie les classements des substances vénéneuses en deux listes : la liste I et la liste II, qui comprend les substances classées dangereuses nécessitant une surveillance médicale, et les substances susceptibles de présenter directement ou indirectement un danger sur la santé. Le minoxidil est classé sur les deux listes.
2001 : interdiction française d'incorporation dans les produits cosmétiques
Le , le minoxidil sous toutes ses formes ainsi que ses dérivés, est inscrit sur la liste des substances interdites en France entrant dans la composition des produits cosmétiques, par l'arrêté du [36].
2005 : entrée du minoxidil pour application locale dosé à 5 %
Le , une autorisation de mise sur le marché est accordée au médicament "Minoxidil Sandoz Conseil" à 5 % de minoxidil, pour application locale en flacon de 60 ml et distribué par l'entreprise pharmaceutique Sandoz[37].
Le , une autorisation de mise sur le marché est accordée au médicament "Minoxidil Bailleul" à 5 % de minoxidil, pour application locale en flacon de 60 ml et distribué par l'entreprise pharmaceutique Laboratoires Bailleul[38].
Les autres groupes pharmaceutiques possédant déjà des médicaments à applications locales dosés à 2 % de minoxidil, obtiendront également après cette date une AMM pour des traitements dosés à 5 % de minoxidil.
2009 : interdiction européenne d'incorporation dans les produits cosmétiques
Le , le minoxidil sous toutes ses formes ainsi que ses dérivés, sont inscrits sur la liste des substances interdites dans l'Union européenne entrant dans la composition des produits cosmétiques par l'article du règlement (CE) n°1223/2009 du Parlement européen et du Conseil du relatif aux produits cosmétiques[39].
En 2012 : autorisation de commercialisation sans prescription médicale
le , une autorisation partielle est accordée au minoxidil sous sa forme topique à la prescription sans ordonnance[40], mais il demeure inscrit sur la liste des substances vénéneuses[35].
Le médicament Lonoten (pour l'hypertension artérielle) est remboursé par la sécurité sociale à hauteur de 65 %[27] - [41]et ne dispose d'aucun médicament générique[41]. Son prix ne peut pas être modifié par les pharmaciens[42], puisqu'il est inscrit sur la liste des médicaments remboursables[27].
Le médicament pour application locale n'est pas remboursé par la sécurité sociale[43]. Il est disponible sous différentes versions génériques depuis que l'entreprise Pharmacia & Upjohn a perdu les droits de brevet en 1996[7]. Les pharmaciens sont libres de fixer son prix[43].
Le minoxidil, qu'il soit sous forme topique à application locale, ou sous forme comprimée par voie orale, est un médicament potentiellement dangereux pour la santé[3]. En tant que médicament, sa vente en France est strictement réservée aux pharmacies françaises[44] - [45] - [46] inscrites sur la liste de l'Ordre national des pharmaciens[45] - [46], et interdite aux moins de 18 ans[40].
Traitement de la chute de cheveux
Le minoxidil ralentit la chute des cheveux chez l'homme et la femme, et dans certains cas, permet d'obtenir une légère repousse. Pour les chutes de cheveux plus importantes, ces résultats seraient renforcés par un traitement associé au finastéride (Propecia).
Le minoxidil est appliqué à raison de deux fois par jour, matin et soir, sur un cuir chevelu sain, cheveux propres et secs.
En début de traitement, le minoxidil va accélérer le processus naturel de la chute des cheveux. Le patient constate une accélération de la chute des cheveux qui s'étend au-delà de sa calvitie d'origine. Les cheveux qui auraient dû tomber naturellement sous plusieurs mois sont perdus en quelques semaines.
Puis en continuant le traitement quotidiennement entre 3 et 6 mois[47] - [48], de nouveaux cheveux très fins apparaissent sur la zone traitée.
Le patient doit continuer le traitement à vie pour garder sa chevelure.
L'application de minoxidil peut provoquer une hypertrichose, qui se traduit par une augmentation de la pilosité. À noter que les personnes ayant une pilosité et des cheveux de couleur brune ou noire sont plus fortement exposées à ces symptômes.
Mécanisme d’action sur le follicule pileux
Le mécanisme d'action complet du minoxidil demeure inconnu sur le corps humain[49].
Le minoxidil active l'ouverture du canal potassique, provoquant une hyperpolarisation de la membrane cellulaire. Cela peut provoquer la perte des follicules dans la phase télogène, qui sont ensuite remplacés par de nouveaux follicules dans la phase anagène. Le minoxidil est converti par sulfatation via sulfotransférase enzyme SULT1A1 à sa forme active, le sulfate de minoxidil. Plusieurs études ont démontré que l'activité de la sulfotransférase dans les follicules pileux anticipe la réponse du minoxidil dans le traitement de l'alopécie androgénétique[47] - [48] - [50] - [51].
Le minoxidil est moins efficace lorsqu'il y a une grande zone de perte de cheveux. En outre, son efficacité a été largement démontrée chez les hommes dont la perte de cheveux a débuté depuis moins de cinq ans. Deux études cliniques sont menées aux États-Unis, pour concevoir un dispositif médical qui pourrait permettre aux patients, de déterminer s'ils sont susceptibles d'échouer au traitement de minoxidil avant de le commencer[52].
Difficultés de mise en œuvre
Comme beaucoup de médicaments, le minoxidil ne soigne pas, il entretient un état pendant son utilisation. On dit qu’il ne fonctionne pas pour tout le monde, mais est-il bien utilisé ?
Avant d’entreprendre ce traitement, il est indispensable de bien connaitre le fonctionnement du système pileux :
Tous les poils de notre corps se renouvellent dans un cycle qui va leur permettre d’avoir une longueur et de la conserver un certain temps : une phase de croissance, une phase de ralentissement et d’arrêt et une phase de repos se terminant par la chute. Par exemple, les cheveux poussent environ pendant trois ans et sont au repos pendant trois mois, les cils poussent pendant un mois et sont au repos trois mois. Certains disent, mes cheveux ne poussent plus, tout comme les cils, c’est simplement que les cheveux les plus longs ont terminé leur période de croissance et sont au repos avant de tomber.
Un autre paramètre génétique va venir jouer un rôle important dans l’alopécie androgénique, c’est le nombre de cycles possible pour une vie. Il est normalement d’environ vingt-cinq à trente cycles, progressivement les cheveux vont aussi perdre en qualité. On peut comprendre facilement que des cycles courts souvent de moins d’un an, peuvent mener rapidement à la calvitie.
Le minoxidil semble être la solution miracle, d’une part, pour allonger la phase de croissance et réduire la chute et d’autre part, pour préserver son capital de cycles.
Mais son utilisation est loin d’être évidente. La difficulté est ce décalage entre le soin et la constatation de la réponse au traitement d'environ trois mois, par exemple, pour un mal de tête, seules quelques heures après la prise d’un médicament suffisent. Pour commencer le traitement, il faudra donc attendre cette longue période sans défaillance avant d’apprécier les résultats et continuer de la sorte pour les maintenir.
Ainsi, l’efficacité du traitement est source de confiance et incite souvent à la négligence, seuls quelques jours d'arrêt suffisent pour provoquer une importante perte de cheveux quelques mois plus tard, une situation qui conduit souvent à l’abandon.
Grossesse et allaitement
Il est bien connu que pendant la période de grossesse, les cheveux sont plus beaux, plus épais, plus brillants. Sous l’effet de la modification hormonale, la phase anagène (croissance des cheveux) va être plus longue et ainsi réduire la chute.
Non seulement il est déconseillé d’utiliser le minoxidil pendant la grossesse mais l’avantage de la surproduction principalement d’œstrogènes pendant cette période le rend parfaitement inutile. Il est cependant judicieux de reprendre le traitement dès l’accouchement à cause de la chute hormonale.
Il y a peu de données concernant l’utilisation du minoxidil pendant l’allaitement. Quoique de très faibles quantités peuvent passer dans le lait maternel, les laboratoires le déconseillent aussi pendant cette période.
Effets secondaires
Comme tous les médicaments, le minoxidil est susceptible d'avoir des effets indésirables, bien que tout le monde n'y soit pas sujet. Les laboratoires s’accordent à les décrire comme suit :
- il est possible que surviennent une irritation locale avec desquamation (élimination des cellules mortes de la peau), démangeaisons, érythème (rougeur de la peau), peau sèche, sensation de brûlure et hypertrichose (développement anormal du système pileux à distance) ou plus rarement des réactions allergiques ;
- dans quelques cas rares, il est possible que surviennent une baisse de la tension artérielle, une accélération du pouls, une chute des cheveux, des cheveux irréguliers, une douleur thoracique, une hépatite ou des calculs rénaux ;
- plus rarement d'autres réactions ont pu être décrites, à type d'allergie (rhinite, éruptions cutanées, rougeur généralisée, gonflement du visage), de vertiges, picotement, maux de tête, faiblesse, œdèmes (infiltration de liquide dans les tissus), altération du goût, infection de l'oreille, troubles de la vision, irritation oculaire, névrite (atteinte d'un nerf).
Il faut cependant noter que ces effets, en particulier ceux qui ont été le plus rarement rapportés, l'ont été sans que l'on puisse formellement établir qu'ils aient été provoqués par le traitement.
Erreur pharmaceutique de 2019
Alors que seuls une cinquantaine de cas d'hypertrichose avaient été documentés dans le monde (d’après JAMA Dermatology), en Espagne une épidémie d'hypertrichose, a en touché 17 enfants et bébés qui ont vu leur visage (front, joues) ainsi que leurs bras, jambes et mains se couvrir d’une épaisse couche de cheveux ou longs poils (les sourcils d'un bébé de 6 mois prenant l’apparence de ceux d’un adulte). Le ministère espagnol de la Santé et l'Agence du médicament ont identifié une erreur pharmaceutique ayant conduit à étiqueter du minoxidil comme étant de l'oméprazole (médicament contre le reflux acide). Le , 22 lots "contaminés" ont été rappelés. Le , l'usine où le médicament a été produit a été fermée par précaution. L’un des enfants au moins a subi des lésions hépatiques, et quatre familles vont intenter un procès à FarmaQuimica (basé à Malaga) qui a interverti les médicaments[53] - [54].
Voir aussi
Article connexe
Liens externes
- Ressources relatives à la santé :
- Notice dans un dictionnaire ou une encyclopédie généraliste :
- http://www.has-sante.fr/portail/jcms/c_1749738/fr/lonoten
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Minoxidil », sur ChemIDplus.
- (en) British Pharmacopoeia Commission Office, « Safety data sheet according to 1907/2006/EC, Article 31, Minoxidil, Identification of the substance », British Pharmacopoeia Commission Office, (lire en ligne)
- Fiche Sigma-Aldrich du composé Minoxidil≥99%, consultée le 10/4/2011., [PDF] Fiche MSDS
- « Pharmacia Merger | Pfizer: One of the world's premier biopharmaceutical companies », sur www.pfizer.com (consulté le )
- Pharmacia
- (en) Norman M. Goldfarb, "Can You Handle the Truth" Journal of Clinical Research Best Practices, Vol. 2, No. 3, March 2006, , 3 p. (lire en ligne)
- Douglas Martin, « Guinter Kahn, Inventor of Baldness Remedy, Dies at 80 », The New York Times, (ISSN 0362-4331, lire en ligne, consulté le )
- (de) Axel Kleemann, Jürgen Engel, Bernd Kutscher et Dietmar Reichert, Pharmaceutical Substances, 4. Auflage (2000), Thieme-Verlag Stuttgart, , 2488 p. (ISBN 978-1-58890-031-9)
- « Minoxidil – Chemie-Schule », sur www.chemie-schule.de (consulté le )
- René Milcent et François Chau, Chimie organique hétérocyclique (Structures fondamentales), EDP Sciences, , 846 p. (ISBN 978-2-7598-0174-9, lire en ligne), p. 634
- Gilmore, E, Weil, J, and Chidsey CA. Treatment of Essential Hypertension with a New Vasodilator in Combination with Beta Adrenergic Blockade, NEJM 282: 521-527, 1970
- Gottlieb, TB, Katz, FH, Chidsey, CA Combined Therapy with Vasodilator Drugs and Beta Adrenergic Blockade, Circulation XLV, 571, 1972
- (Archives médicales nationale Américaines) « Loniten® minoxidil tablets, USP », sur dailymed.nlm.nih.gov (consulté le )
- (en) Peter Conrad, The Medicalization of Society : On the Transformation of Human Conditions into Treatable Disorders, JHU Press, , 224 p. (ISBN 978-0-8018-9234-9 et 0-8018-9234-1, lire en ligne), p. 37
- (en) Will Lester, « Hair-rasing tale: no fame for men who discovered Rogaine », The Daily Gazette, , p. 4 (lire en ligne)
- « History of The Upjohn Company – FundingUniverse », sur www.fundinguniverse.com (consulté le )
- Paula Kepos, International Directory of Company Histories, Vol. 8, St. James Press,
- (en) Harry Wesselt, Orlando Sentinel, « Rogaine: Bald Truth », Chicago Tribune, (lire en ligne)
- « LONITEN® | Pfizer: One of the world's premier biopharmaceutical companies », sur www.pfizer.com (consulté le )
- « LONITEN (comprimés de minoxidil, USP) | Pfizer Canada », sur Pfizer Canada (consulté le )
- « ODDB.org: Open Drug Database | Médicaments | Information destinée au patient », sur oekk.oddb.org (consulté le )
- « Résumé des caractéristiques du produit - LONOTEN 10 mg, comprimé sécable - Base de données publique des médicaments », sur base-donnees-publique.medicaments.gouv.fr (consulté le )
- V.C., « Johnson & Johnson cherche à céder son usine d'Orléans », Les Echos, (lire en ligne)
- « Mens rogaine Unscented Formula (Johnson & Johnson Healthcare Products, Division of McNEIL-PPC, Inc.) Minoxidil 50mg in 1g aerosol, foam », sur www.drugs.com (consulté le )
- Dr Pascal Reygagne, Finasteride et minoxidil en 2014, Paris, , 48 p. (lire en ligne), p. 3
- HAS - Direction de l'Evaluation Médicale, Economique et de Santé Publique, COMMISSION DE LA TRANSPARENCE Avis 11 juin 2014, (lire en ligne)
- Journal Officiel de la République Française, Modification de l'arrêté du 8 février 1983 modifiant l'arrêté du 21 janvier 1957, (lire en ligne), p. 1886
- « Autorisation REGAINE 2 POUR CENT, solution pour application cutanée », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation ALOSTIL 2 POUR CENT, solution pour application cutanée », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation MINOXIDIL COOPER 2 %, solution pour application cutanée en flacon », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation MINOXIDIL SINCLAIR 2 POUR CENT, solution pour application cutanée en flacon », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation MINOXIDIL RPG 2 POUR CENT, solution pour application locale en ampoule », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation MINOXIDIL CS 2 POUR CENT, solution pour application cutanée en ampoule », sur agence-prd.ansm.sante.fr (consulté le )
- Journal Officiel de la République Française, Arrêté du 22 février 1990 portant exonération à la réglementation des substances vénéneuses destinées à la médecine humaine, version consolidée au 02 septembre 2016 (lire en ligne)
- Journal Officiel de la République Française, Arrêté du 6 février 2001 fixant la liste des substances qui ne peuvent entrer dans la composition des produits cosmétiques, version consolidée au 02 septembre 2016 (lire en ligne)
- « Autorisation MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée », sur agence-prd.ansm.sante.fr (consulté le )
- « Autorisation MINOXIDIL BAILLEUL 5 %, solution pour application cutanée », sur agence-prd.ansm.sante.fr (consulté le )
- Journal officiel de l’Union européenne, RÈGLEMENT (CE) N°1223/2009 DU PARLEMENT EUROPÉEN ET DU CONSEIL du 30 novembre 2009 relatif aux produits cosmétiques, (lire en ligne)
- JORF, 25 janvier 2012 (lire en ligne)
- « Fiche info - LONOTEN 10 mg, comprimé sécable - Base de données publique des médicaments », sur base-donnees-publique.medicaments.gouv.fr (consulté le )
- « Le Pharmacien - Le référentiel des prix », sur www.lepharmacien.fr (consulté le )
- Pôle documentation de l’Irdes: Marie-Odile Safon, Véronique Suhard, relecture: Sylvain Pichetti, « Historique de la politique du médicament en France », institut de recherche et de documentation en économie de la santé - irdes.fr, , p. 9 (lire en ligne)
- « La lutte contre l'exercice illégal de la pharmacie - Nos missions - Ordre National des Pharmaciens », sur www.ordre.pharmacien.fr (consulté le )
- « Vente de médicaments sur Internet en France », sur Conseil national de l'ordre des pharmaciens, (consulté le )
- « Rechercher un site autorisé pour la vente en ligne de médicaments Ordre National des Pharmaciens », sur www.ordre.pharmacien.fr (consulté le )
- (en) Andy Goren, Jerry Shapiro, Janet Roberts et John McCoy, « Clinical utility and validity of minoxidil response testing in androgenetic alopecia », Dermatologic Therapy, vol. 28, , p. 13–16 (ISSN 1529-8019, DOI 10.1111/dth.12164, lire en ligne, consulté le )
- Andy Goren, Jerry Shapiro, Janet Roberts et John McCoy, « Clinical utility and validity of minoxidil response testing in androgenetic alopecia », Dermatologic Therapy, vol. 28, , p. 13–16 (ISSN 1529-8019, PMID 25112173, DOI 10.1111/dth.12164, lire en ligne, consulté le )
- (en) Rossi A, Cantisani C, Melis L, Iorio A, Scali E, Calvieri S, « Minoxidil use in dermatology, side effects and recent patents », PubMed, (lire en ligne)
- (en) Janet Roberts, Nisha Desai, John McCoy et Andy Goren, « Sulfotransferase activity in plucked hair follicles predicts response to topical minoxidil in the treatment of female androgenetic alopecia », Dermatologic Therapy, vol. 27, , p. 252–254 (ISSN 1529-8019, DOI 10.1111/dth.12130, lire en ligne, consulté le )
- (en) Andy Goren, Juan Antonio Castano, John McCoy et Fernando Bermudez, « Novel enzymatic assay predicts minoxidil response in the treatment of androgenetic alopecia », Dermatologic Therapy, vol. 27, , p. 171–173 (ISSN 1529-8019, DOI 10.1111/dth.12111, lire en ligne, consulté le )
- « Minoxidil Response Testing in Males With Androgenetic Alopecia - Full Text View - ClinicalTrials.gov », sur clinicaltrials.gov (consulté le )
- Espagne : les bébés «loup-garou» avaient pris le mauvais médicament ; Les parents croyaient avoir administré à leur enfant un médicament contre le reflux gastrique, alors que la boîte contenait un remède contre la chute des cheveux. Le Parisien ; 29-08-2019
- Isobel Whitcomb (2019) More Than a Dozen Babies in Spain Developed 'Werewolf Syndrome' from Drug Mix-Up Live Science 2019-08-29