Lumbricidae
Lumbricidae, les Lombricidés sont une famille de vers de terre caractéristique des régions tempérées de l'hémisphère nord et initialement originaire de la zone paléarctique (Europe, Afrique du Nord, Moyen-Orient et Asie).

Elle compose l'essentiel de la faune de vers de terre européenne. Introduite en Amérique du Nord avec l'arrivée des premiers Européens, elle s'est répandue jusqu'à composer aujourd'hui la quasi-totalité des espèces canadiennes à l'Est des Rocheuses. Elle a également été introduite dans les régions tempérées de l'hémisphère sud où elle prospère aujourd'hui (Australie, Afrique du Sud, Patagonie). Cette famille comprend plusieurs centaines d'espèces.
Ces espèces jouent un rôle majeur en termes de services écosystémiques, notamment par le travail du sol que les vers assurent, et par le rôle qu'ils jouent dans le cycle de la matière organique et du carbone dans le sol, ainsi qu'en matière de cinétique de métaux lourds et métalloïdes dans l'environnement (dans les sols pollués notamment)
Écologie
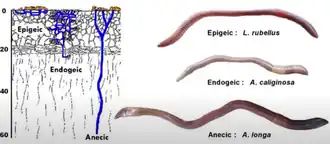
Les Lombricidés ont été classé en 3 catégories écologiques par l'agronome Marcel Bouché dans les années 1970 en s’appuyant sur des critères morphologiques, physiologiques et écologiques[1] : les épigés, les endogés et les anéciques.
Les vers de terre épigés sont de petite taille et souvent de couleur brune pour se camoufler et se protéger des rayons lumineux. Ils vivent à la surface, dans des milieux riches en matière organique, notamment dans la litière dont ils se nourrissent et ne creusent pas ou très peu de galerie. Leur capacité de reproduction est très élevée, leur croissance rapide, leur mobilité importante et leur longévité courte[1] - [2]. Ce sont notamment le Lombric châtain, Satchellius mammalis, le ver du fumier et Dendrobaena octaedra[3].
Les vers de terre endogés sont de taille petite à moyenne et de couleur claire ou dépourvus de pigmentation. Ils vivent continuellement dans les premiers niveaux du sol où ils produisent un réseau de galeries horizontales très ramifié et temporaire. Ils se nourrissent soit de racines mortes (saprophagie), soit de matière organique plus ou moins intégrée à la matière minérale (géophagie). Leur capacité de reproduction est moins rapide que celle des épigés et leur longévité plus importante[1] - [2]. Ce sont par exemple la forme typique d'Aporrectodea caliginosa, Le Lombric rose, de couleur rosâtre ; le Lombric bleu et le Lombric marbré de couleur blanchâtre et la forme typique du Lombric vert, de couleur verdâtre[3].
Les vers de terre anéciques sont de taille moyenne à géante, et sont colorés de rouge à brun grisâtre. Ils vivent sur l'ensemble du sol où ils produisent un réseau de galerie verticales peu ramifié et permanent qui débouchent à la surface pour permettre à l'eau et à l'air de communiquer. Ils se nourrissent de la matière organique végétale de la surface et y déposent leurs déjections, nommées turricules. Leur capacité de reproduction est lente et leur longévité longue. Lors des périodes trop sèches et trop froides, ces espèces survivent grâce à une mise en inactivité nommée diapause ou quiescence[1] - [2]. Ces espèces sont divisées en deux groupes selon leur morphologie. : les vers à tête rouge, au premier quart coloré de rouge à rouge pale, au clitellum orange et globalement trapu (ce sont par exemple le Lombric commun et Lumbricus rubellus rubellus) et les vers à tête noire, au premier quart coloré de noir à gris clair, au clitellum marron à marron clair et au pore male rosâtre bien visible à l’œil nu (par exemple Aporrectodea longa)[3].
Cycle de vie

Tous les Lombricidés sont originellement des hermaphrodites. Certains pratiquent une reproduction sexuée dite « bi-parentale » comme le Lombric commun. Plus précisément, ils sont hermaphrodites protandre, c'est-à-dire que chaque individu est alternativement mâle puis femelle. Deux vers mâles s'accouplent au niveau de leur clitellum (la bague colorée gonflée située au tiers antérieur du corps qui est la caractéristique générale des Anéciques), en contact tête-bêche. Après l'échange réciproque de leurs spermatozoïdes, ils les conservent et se transforment en femelle. Leur clitellum produit alors une capsule nommée cocon auquel ils adjoignent un ou plusieurs ovules qu'ils fécondent avec les spermatozoïdes de leur ancien partenaire. Ils font enfin glisser le cocon le long de la partie antérieure de leur corps jusqu'à ce qu'il s'en détache et se ferme à ses deux extrémités. Il est alors émis dans le sol. D'autres espèces pratiquent une reproduction asexuée, la parthénogénèse, à partir de leurs seules gamètes[4].

Les vers adultes produisent des quantités différentes de cocons par an, suivant leur âge, les conditions climatiques comme la sécheresse et le froid et leurs conditions de vie, notamment la pollution[5] - [6]; des critères qui déterminent également la durée d’incubation[7] - [8]. Des espèces anéciques ou endogées comme Aporrectodea caliginosa, le Lombric à tête noire et le Lombric bleu produisent entre 3 et 13 cocons par an alors que les épigés comme Lumbricus rubellus, le Lombric châtain et Dendrobaena rubidus sont capables d’en produire entre 42 et 106 par an[9]. Quant au Lombric commun, il peut produire entre 10 et 25 cocons par an en fonction des conditions de température[10]. Les cocons sont résistants à certaines conditions extrêmes comme la sécheresse, même si elle provoque leur déshydratation et retarde le développement de l'embryon. C'est notamment le cas pour Lumbricus rubellus, chez qui il n'est pas rare que seul le cocon survive aux estivations[11].
De ces cocons éclosent un ou plusieurs juvéniles, leur nombre par cocons étant variable en fonction de l'espèce : 20 % des naissances du Lombric bleu sont des jumeaux alors qu'elles ne sont que 1 % chez le Lombric commun et le Lombric à tête noire[12]. Chez le Lombric du fumier, un maximum 11 vers par cocon a été trouvé[13].
Le ver de terre juvénile acquiert d'abord des caractères sexuels sub-adultes comme le puberculum tuberculeux et les pores sexuels. Puis vient le caractère sexuel adulte typique, un organe lié au processus de ponte : le clitellum qui ressemble à une bague colorée gonflée située au tiers antérieur du corps. Mais ce temps de maturation est particulièrement variable d'une espèce à une autre et fonction des conditions de milieux comme la température, l'humidité et la nourriture disponible. Par exemple, un juvénile Aporrectodea caliginosa devient mature en 3 à 6 semaines[14]. Au champ, le Lombric commun devient mature généralement en 1 an[15] alors qu’il ne lui suffira que de quelques mois pour atteindre la maturité sexuelle en conditions de laboratoire[16].
La durée de vie des Lombricidés dépend de l’espèce, de leur biotope et des contraintes climatiques. Ainsi, le Lombric commun peut vivre plusieurs années en conditions de laboratoire[15] alors qu’en conditions naturelles et particulièrement dans les champs cultivés, son espérance de vie diminue à quelques mois[9]. Suivant le groupe, les stratégies varient entre les types « r » et les types « K », c'est-à-dire entre les espèces à durée de vie courte qui privilégient une reproduction prolifique et une croissance rapide, à savoir les épigés, et les espèces qui privilégient une durée de vie longue au détriment de la reproduction et de la croissance, à savoir les anéciques ; les endogés ayant une stratégie intermédiaire[17].
Rôles écosystémiques
Les vers de terre et plus particulièrement les Lumbricidae sont des espèces ingénieures du sol car ils structurent le sol, stimulent l'activité microbienne, décomposent et brassent la matière organique tout en l'agrégeant aux éléments minéraux, aèrent et permettent une meilleure infiltration et rétention de eau. Ce réaménagement du sol, nommé bioturbation, a de nombreux bénéfices notamment la réduction de l’érosion, l’augmentation de la production végétale ainsi que la réduction des risques de pollution[18].
Menaces

Du fait de leur localisation dans les couches supérieures du sol et de leur régime alimentaire, les vers de terre se trouvent parmi les premiers être vivants à être impactés par les polluants auxquels ils sont très sensibles. Ce sont par conséquent de très bon Bioindicateurs en rendant compte de l’état et des usages de l’écosystème que constitue le sol. C'est notamment le cas des populations vivant à proximité des zones industrielles et des zones urbaines qui sont contaminées par des métaux lourds comme le zinc, le cuivre, le cadmium, le mercure et le plomb[19] - [20]. Les microplastiques représentent aussi une sérieuse menace pour les populations de vers de terre, surtout pour leur reproduction[6]. Au niveau agricole, les milieux voués à l'agriculture industrielle et pollués aux insecticides tels que les néonicotinoïdes représentent une menace directe pour les vers de terre et leurs prédateurs en s'accumulant également dans la chaîne alimentaire. À l'inverse, l'abondance des vers de terre augmente lorsque l’usage des pesticides diminue, les parcelles gérées en agriculture biologique étant plus favorables que celles en conventionnel[21] - [22] - [23].
Les espèces invasives comme le ver plat Obama nungara[24] et la luciole Photinus signaticollis[25] sont des espèces prédatrices de vers de terre qui font craindre une forte menace chez les épigées et les anéciques comme les endogées.
Principaux genres et espèces de France
Selon Ecobiosoil de l'Université de Rennes[2] pour la liste des espèces, et Termium plus[26] pour les noms normalisés français :
- Allolobophora
- Aporrectodea
- Bimastos
- Dendrobaena
- Dendrobaena octaedra, le Lombric à queue octogonale
- Dendrobaena pygmaea
- Dendrobaena veneta, le Dendro
- Eisenia
- Octolasion
- Lumbricus
- Lumbricus castaneus, le Lombric châtain
- Lumbricus centralis
- Lumbricus rubellus, le Lombric des marais
- Lumbricus terrestris, le Lombric commun
- Lumbricus friendi
- Satchellius
Ensemble des genres
Selon World Register of Marine Species (13 janvier 2021)[27] :
- Allolobophora Eisen, 1874
- Alpodinaridella Mršić, 1987
- Aporrectodea Orley, 1885
- Bimastos Moore, 1893
- Cataladrilus Qiu & Bouché, 1998
- Cernosvitovia Omodeo, 1956
- Creinella Mršić, 1986
- Dendrobaena Eisen, 1874
- Eisenia Malm, 1877
- Eiseniella Michaelsen, 1900
- Eiseniona Omodeo, 1956
- Eophila Rosa, 1893
- Ethnodrilus Bouché, 1972
- Eumenescolex Qiu & Bouché, 1998
- Fitzingeria Zicsi, 1978
- Gatesona Qiu & Bouché, 1998
- Healyella Omodeo & Rota, 1989
- Helodrilus Hoffmeister, 1845
- Heraclescolex Qiu & Bouché, 1998
- Iberoscolex Qiu & Bouché, 1998
- Italobalkaniona Mršić & Šapkarev, 1988
- Kenleenus Qiu & Bouché, 1998
- Kritodrilus Dumnicka, 1983
- Lumbricus Linnaeus, 1758
- Meroandriella Mršić, 1987
- Murchieona Gates, 1978
- Octodriloides Zicsi, 1986
- Octodrilus Omodeo, 1956
- Octolasion Örley, 1885
- Omilurus Templeton, 1836
- Orodrilus Bouché, 1972
- Perelia Easton, 1983
- Philomontanus Bozorgi, Seiedy, Malek, Aira, Pérez-Losada & Domínguez, 2019
- Pietromodeona Qiu & Bouché, 1998
- Postandrilus Qiu & Bouché, 1998
- Proctodrilus Zicsi, 1985
- Prosellodrilus Bouché, 1972
- Reynoldsia Qiu & Bouché, 1998
- Satchellius Gates, 1975
- Scherotheca Bouché, 1972
- Spermophorodrilus Bouché, 1975
- Zophoscolex Qiu & Bouché, 1998
Notes et références
- Bouché M.B, « Stratégie lombriciennes. », Ecological Bulletin (Stockholm), vol. 25, , p. 122-132 (lire en ligne)
- Fiches de présentation des espèces communes chez les lombriciens, OPVT, EcoBioSoil, Université de Rennes (lire en ligne)
- Guide illustratif "Déterminer les vers de terre, OPVT, EcoBioSoil, Université de Rennes (lire en ligne)
- Darío J. Díaz Cosín, Marta Novo et Rosa Fernández, « Reproduction of Earthworms: Sexual Selection and Parthenogenesis », dans Biology of Earthworms, vol. 24, Springer Berlin Heidelberg, (ISBN 978-3-642-14635-0, DOI 10.1007/978-3-642-14636-7_5), p. 69–86
- (en) Tina S. Svendsen, Poul Einer Hansen, Christian Sommer et Torben Martinussen, « Life history characteristics of Lumbricus terrestris and effects of the veterinary antiparasitic compounds ivermectin and fenbendazole », Soil Biology and Biochemistry, vol. 37, no 5, , p. 927–936 (DOI 10.1016/j.soilbio.2004.10.014)
- (en) Elma Lahive, Alexander Walton, Alice A. Horton et David J. Spurgeon, « Microplastic particles reduce reproduction in the terrestrial worm Enchytraeus crypticus in a soil exposure », Environmental Pollution, vol. 255, , p. 113174 (DOI 10.1016/j.envpol.2019.113174)
- (en) Martin Holmstrup et Karl Erik Zachariassen, « Physiology of cold hardiness in earthworms », Comparative Biochemistry and Physiology Part A: Physiology, vol. 115, no 2, , p. 91–101 (DOI 10.1016/0300-9629(96)00010-2)
- (en) Phillipson et Bolton, « Growth and cocoon production of Allolobophora rosea (Savigny) (Lumbricidae) », Pedobiologia, vol. 17, , p. 70-82
- (en) Satchell, John E., « Lumbricidae. », Soil biology,
- (en) Kevin R Butt et Visa Nuutinen, « Reproduction of the earthworm Lumbricus terrestris Linné after the first mating », Canadian Journal of Zoology, vol. 76, no 1, , p. 104–109 (ISSN 0008-4301 et 1480-3283, DOI 10.1139/z97-179)
- C. A. Edwards et C. A. Edwards, Biology and ecology of earthworms., Chapman & Hall, (ISBN 0-412-56160-3 et 978-0-412-56160-3, OCLC 35666444, lire en ligne)
- (en) Butt K. R., « Reproduction and growth of three deep-burrowing earthworms (Lumbricidae) in laboratory culture in order to assess production for soil restoration. », Biology and Fertility of Soils, vol. 16, , p. 135-138
- (en) Roy Hartenstein et Frances Hartenstein, « Physicochemical Changes Effected in Activated Sludge by the Earthworm Eisenia foetida », Journal of Environmental Quality, vol. 10, no 3, , p. 377–381 (ISSN 0047-2425 et 1537-2537, DOI 10.2134/jeq1981.00472425001000030027x)
- (en) Boström, U., and A. Lofs, « Annual population dynamics of earthworms and cocoon production by Aporrectodea caliginosa in a meadow rescue ley. », Pedobiologia, vol. 40, no 1, , p. 32-42
- K. H. Lakhani et J. E. Satchell, « Production by Lumbricus terrestris (L.) », The Journal of Animal Ecology, vol. 39, no 2, , p. 473 (DOI 10.2307/2983, lire en ligne)
- Christopher Lowe et Kevin Butt, « Growth of hatchling earthworms in the presence of adults: interactions in laboratory culture », Biology and Fertility of Soils, vol. 35, no 3, , p. 204–209 (ISSN 0178-2762 et 1432-0789, DOI 10.1007/s00374-002-0471-7)
- (en) J. E. Satchell, « Earthworm ecology in forest soils », dans Earthworm Ecology, Springer Netherlands, (ISBN 978-94-009-5967-5, DOI 10.1007/978-94-009-5965-1_13), p. 161–170
- Marinussen, M.P., J. C. van der Zee, E.A. Sjoerd, T. M. de Haan, A.M.Frans (1997). Heavy metal (copper, lead, and zinc) accumulation and excretion by the earthworm, Dendrobaena veneta. Journal of Environmental Quality 26:278-284
- (en) J.E Morgan et A.J Morgan, « The accumulation of metals (Cd, Cu, Pb, Zn and Ca) by two ecologically contrasting earthworm species (Lumbricus rubellus and Aporrectodea caliginosa): implications for ecotoxicological testing », Applied Soil Ecology, vol. 13, no 1, , p. 9–20 (DOI 10.1016/S0929-1393(99)00012-8)
- (en) D. V. Nesterkova, E. L. Vorobeichik et I. S. Reznichenko, « The effect of heavy metals on the soil-earthworm-European mole food chain under the conditions of environmental pollution caused by the emissions of a copper smelting plant », Contemporary Problems of Ecology, vol. 7, no 5, , p. 587–596 (ISSN 1995-4255 et 1995-4263, DOI 10.1134/S1995425514050096)
- Bernard Guillot, « Les sols de nos campagnes gorgés de résidus de pesticides », sur Zoom Nature, (consulté le )
- (en) C. Pelosi, C. Bertrand, G. Daniele et M. Coeurdassier, « Residues of currently used pesticides in soils and earthworms: A silent threat? », Agriculture, Ecosystems & Environment, vol. 305, , p. 107167 (DOI 10.1016/j.agee.2020.107167, lire en ligne, consulté le )
- (en) J.-M. Bonmatin, C. Giorio, V. Girolami et D. Goulson, « Environmental fate and exposure; neonicotinoids and fipronil », Environmental Science and Pollution Research, vol. 22, no 1, , p. 35–67 (ISSN 0944-1344 et 1614-7499, PMID 25096486, PMCID PMC4284396, DOI 10.1007/s11356-014-3332-7, lire en ligne)
- Jean-Lou Justine et Virginie Roy, « Invasion dans nos jardins : nouvelles révélations sur le ver plat mangeur de vers de terre », The Conversation, (lire en ligne, consulté le )

- (en) Marcel Koken, José Ramón Guzmán-Álvarez, Diego Gil-Tapetado et Miguel Angel Romo Romo Bedate, « Quick Spreading of Populations of an Exotic Firefly throughout Spain and Their Recent Arrival in the French Pyrenees », Insects, vol. 13, no 2, , p. 148 (ISSN 2075-4450, DOI 10.3390/insects13020148, lire en ligne, consulté le )
- « Termium plu, la banque de données terminologiques et linguistiques du gouvernement du Canada. », (consulté le )
- World Register of Marine Species, consulté le 13 janvier 2021
Liens externes
- (en) Référence Animal Diversity Web : Lumbricidae (consulté le )
- (en) Référence Catalogue of Life : Lumbricidae Rafinesque, 1815 (consulté le )
- (fr+en) Référence EOL : Lumbricidae (consulté le )
- (en) Référence Fauna Europaea : Lumbricidae (consulté le )
- (fr+en) Référence GBIF : Lumbricidae (consulté le )
- (fr) Référence INPN : Lumbricidae Claus, 1876 (TAXREF) (consulté le )
- (fr+en) Référence ITIS : Lumbricidae (consulté le )
- (en) Référence OEPP : Lumbricidae (consulté le )
- (en) Référence World Register of Marine Species : taxon Lumbricidae Claus, 1876 (+ liste espèces) (consulté le )
- Écobiosoil de l'Université de Rennes, dédié à l’étude de la biodiversité des sols en milieu tempéré.
- Clés de détermination papier et interactive sur Écobiosoil de l'Université de Rennes.