Iodure de baryum
L'iodure de baryum est un composé inorganique de formule brute BaI2 . Le composé existe sous la forme d'un anhydre et d'un hydrate (BaI2(H2O)2), qui sont tous deux des solides blancs. Lorsqu'il est chauffé, l'iodure de baryum dihydraté se transforme en sel anhydre. La forme hydratée est soluble dans l'eau, l'éthanol et l'acétone .
| Iodure de baryum | |
| |
| Identification | |
|---|---|
| Nom UICPA | Iodure de baryum |
| No CAS | (anhydre)
(dihydraté) |
| No ECHA | 100.033.873 |
| PubChem | 83684 |
| Apparence | Solide blanc (BaI2 anhydre), cristaux incolores (BaI2·2H2O) |
| Propriétés chimiques | |
| Formule | BaI2 BaI2·2H2O |
| Masse molaire[1] | 391,136 ± 0,007 g/mol Ba 35,11 %, I 64,89 %, |
| Susceptibilité magnétique | 124,0·10-6 cm3mol |
| Propriétés physiques | |
| T° fusion | 711 °C (anhydre)
740 °C (composé dihydraté) |
| Solubilité | 1667 g/L (eau, 0 °C)
2210 g/L (eau, 20 °C) 2466 g/L (eau, 70 °C) |
| Masse volumique | 5,15 g/cm3 (anhydre)
4,916 g/cm3 (dihydraté) |
| Thermochimie | |
| ΔfH0liquide | −602,1 kJ/mol-1 |
| Cristallographie | |
| Système cristallin | orthorhombique |
| Symbole de Pearson | oP12 |
| Classe cristalline ou groupe d’espace | n°62
Hermann-Pauguin court : Pnma |
| Composés apparentés | |
| Autres cations | Iodure de béryllium |
| Autres anions | Fluorure de baryum |
| Unités du SI et CNTP, sauf indication contraire. | |
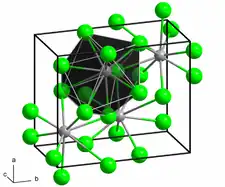
Structure
La structure de la forme anhydre ressemble à celle du chlorure de plomb(II) avec chaque centre Ba lié à neuf ligands iodure[2] et possède une structure cristalline assez similaire à BaCl2[3]
Réactions
L'iodure de baryum anhydre peut être préparé en traitant le métal Ba avec du 1,2-diiodoéthane dans de l'éther[4] .
L'iodure de baryum réagit avec les composés alkylpotassium pour former des composés organobaryum[5].
L'iodure de baryum peut être réduit avec du biphénylide de lithium, pour donner une forme hautement active de baryum métallique[6].
Sécurité
Comme tous les sels de baryum, l'iodure de baryum est un composé toxique.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. (ISBN 0-19-855370-6)
- Brackett, E. B.; Brackett, T. E.; Sass, R. L.; The Crystal Structures of Barium Chloride, Barium Bromide, and Barium Iodide.
- Duval, E.; Zoltobroda, G.; Langlois, Y.; A new preparation of BaI2: application to (Z)-enol ether synthesis.
- Walter, M. D.; Wolmershauser, G.; Sitzmann, H.; Calcium, Strontium, Barium, and Ytterbium Complexes with Cyclooctatetraenyl or Cyclononatetraenyl Ligands.
- Yanagisawa, A.; Habaue, S.; Yasue, K.; Yamamoto, H.; Allylbarium Reagents: Unprecedented Regio- and Stereoselective Allylation Reactions of Carbonyl Compounds.
- (Anglais) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Barium iodide » (voir la liste des auteurs).