Interface sédiment-eau
En océanographie et en limnologie, l'interface sédiment-eau est la frontière entre les sédiments du lit et la colonne d'eau sus-jacente. Le terme fait généralement référence à une couche mince (environ 1 cm de profondeur, quoique variable) d'eau au-dessus de la surface même des sédiments du fond aquatique. Dans l'océan, les estuaires et les lacs, cette couche interagit avec l'eau au-dessus d'elle par le biais d'un écoulement physique et de réactions chimiques médiées par les micro-organismes, les animaux et les plantes vivant au fond du plan d'eau[1]. La topographie de cette interface est souvent dynamique, car elle est affectée par des processus physiques (par exemple des courants provoquant des ondulations ou une remise en suspension) et des processus biologiques (par exemple des bioturbations générant des monticules ou des tranchées). Certains processus physiques, biologiques et chimiques se produisent à l'interface sédiments-eau en raison d'un certain nombre de gradients tels que les gradients de potentiel chimique, les gradients d'eau interstitielle et les gradients d'oxygène[1].

Définition
L'emplacement du sommet de l'interface sédiment-eau dans la colonne d'eau est défini comme la rupture du gradient vertical de certains composants dissous, tels que l'oxygène, où la concentration passe d'une concentration plus élevée dans l'eau bien mélangée au-dessus à une concentration plus faible à la surface des sédiments. Cela peut inclure moins de 1 mm à plusieurs mm de la colonne d'eau[2] - [3].
Processus physiques

Le mouvement physique de l'eau et des sédiments modifie l'épaisseur et la topographie de l'interface sédiment-eau. La remise en suspension des sédiments par les vagues, les marées ou d'autres forces perturbatrices (par exemple, les pieds humains sur une plage) permet à l'eau interstitielle des sédiments et à d'autres composants dissous de se diffuser hors des sédiments et de se mélanger à l'eau dans le volume au-dessus[4]. Pour que la remise en suspension se produise, le mouvement de l'eau doit être suffisamment puissant pour exercer une forte contrainte de cisaillement critique supérieure à la contrainte de cisaillement du lit de sédiments. Par exemple, un lit très compacté ne serait remis en suspension que sous une contrainte de cisaillement critique élevée, tandis qu'une « couche de duvet » de particules très lâches pourrait être remise en suspension sous une contrainte de cisaillement critique faible[5]. Selon le type de lac, il peut y avoir un certain nombre d'événements de mélange chaque année qui peuvent influencer l'interface des sédiments. Les lacs amitiques sont stratifiés en permanence, de même, les lacs méromictiques ne se mélangent pas (ou très peu). Les lacs polymictiques voient le mélange se faire fréquemment et les lacs dimictiques se mélangent deux fois par an. Ce type de mélange lacustre est un processus physique qui peut être entraîné par des vents de surface, des différences de température ou une contrainte de cisaillement dans le lac[1].
Les processus physiques qui affectent l'interface sédiments-eau comprennent, sans s'y limiter :
- la remise en suspension
- le dépôt
- les clapotis (soit de petites ondulations de vagues ou des ondulations de courant géantes )
- les courants de turbidité
- la consolidation des lits ou compactage
Processus biologiques
Les interactions entre les sédiments et les organismes vivant dans les sédiments peuvent également modifier les flux d'oxygène et d'autres composants dissous à l'intérieur et à l'extérieur de l'interface sédiment-eau. Les animaux comme les vers, les mollusques et les échinodermes peuvent favoriser la remise en suspension et le mélange par le mouvement et la construction de terriers[6]. Les micro-organismes tels que les algues benthiques peuvent stabiliser les sédiments et maintenir l'interface sédiment-eau dans un état plus stable en construisant des tapis de Biofilms. L'effet stabilisant de ces tapis de microalgues est en partie dû au caractère collant des substances exopolymères (EPS) ou de la « colle » biochimique qu'ils sécrètent[7].
Les processus biologiques qui affectent l'interface sédiments-eau comprennent, sans s'y limiter :
- Bioturbation
- Biofilms
- Utilisation bactérienne de différents "aliments" chimiques (voir Réactions redox)
- Reminéralisation du carbone organique et des détritus.
Procédés chimiques
Il existe plusieurs processus chimiques qui se produisent de manière abiotique (par réactions chimiques uniquement), ainsi que biotique (réactions microbiennes ou enzymatiques)[8]. Par exemple, les réactions d'oxydoréduction (redox) peuvent se produire simplement par le biais de réactions d'éléments ou par des bactéries oxydantes/réductrices. Les transformations et le renouvellement des éléments entre les sédiments et l'eau se produisent par le biais de processus chimiques abiotiques, ou de chimie microbiologique[1].
Abiotique
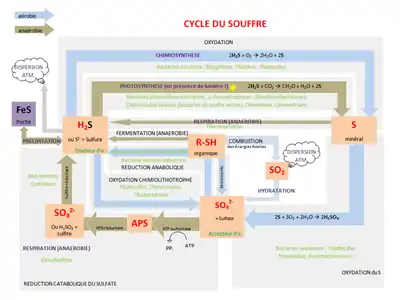
Des réactions chimiques peuvent se produire à l'interface sédiments-eau, de manière abiotique. Cela inclut l'oxygénation des sédiments lacustres en fonction de la teneur en fer libre dans les sédiments (c'est-à-dire la formation de pyrite dans les sédiments), ainsi que la disponibilité du soufre via le cycle du soufre[9]. La sédimentation est souvent le processus de balayage final qui élimine les traces de produits chimiques et d'éléments de la colonne d'eau[1]. Les sédiments à cette interface sont plus poreux et peuvent contenir un plus grand volume d'eau interstitielle dans les sites interstitiels en raison de la teneur élevée en matière organique et du manque de décantation. Par conséquent, les composés chimiques dans l'eau peuvent subir ici deux processus principaux : la diffusion et le mélange biologique[1]. La diffusion chimique à l'intérieur et à l'extérieur des espaces interstitiels se produit principalement par le biais d'un mouvement moléculaire aléatoire[10]. Bien que la diffusion soit le mode principal par lequel les produits chimiques interagissent avec les sédiments, il existe un certain nombre de processus de mélange physique qui facilitent ce processus (voir infra). Les flux chimiques dépendent de plusieurs paramètres tels que le pH et le potentiel chimique. En fonction des paramètres de répartition d'un produit chimique spécifique, le produit chimique peut rester en suspension dans la colonne d'eau, se répartir dans le biote, se répartir dans les solides en suspension ou se répartir dans les sédiments[11]. De plus, la première loi de diffusion de Fick stipule que le taux de diffusion est fonction de la distance ; avec le temps, le profil de concentration devient linéaire[11]. La disponibilité d'une variété de contaminants lacustres est déterminée par les réactions qui se produisent dans le système d'eau douce.
Les réactions chimiques à l'interface sédiment-eau sont énumérées ci-dessous :
des lacs
Lors du passage des eaux sus-jacentes à l'interface sédiment-eau, il y a une augmentation de 3 à 5 ordres de grandeur du nombre de bactéries[12]. Bien que les bactéries soient présentes dans l'interface de tout le bassin du lac, leur distribution et leur fonction varient selon le substrat, la végétation et la lumière du soleil. Par exemple, la population bactérienne à l'interface sédiment-eau dans une zone littorale végétative a tendance à être plus importante que la population de la zone plus profonde[13], en raison de la teneur plus élevée en matière organique dans la première. Et, un artefact fonctionnel de la végétation dense dans l'interface pourrait être dû à un plus grand nombre d'azotobacter, un genre de bactéries qui peuvent fixer LN2 à l'ammonium ionisé (NH4+).
Même si la morphométrie du bassin joue un rôle dans la répartition des bactéries dans le lac, les populations et fonctions bactériennes sont principalement déterminées par la disponibilité d'oxydants/accepteurs d'électrons spécifiques (par exemple, O2, NO3−, SO4−, CO2). Ces constituants, diffusés à partir de l'eau sus-jacente ou des sédiments sous-jacents, peuvent être utilisés et/ou formés au cours du métabolisme bactérien par différents organismes ou être rejetés dans la colonne d'eau. Les pentes redox abruptes présentes dans l'interface sédiments-eau permettent à une variété d'organismes aérobies et anaérobies de survivre et à diverses transformations redox d'avoir lieu. Voici quelques-unes des réactions d'oxydoréduction à médiation microbienne qui peuvent avoir lieu au sein de l'interface sédiment-eau.
- Respiration aérobie
- Fixation de l'azote
- Dénitrification [ anammox ]
- Réduction du manganèse
- Réduction du fer
- Réduction des sulfates
- Méthanogenèse
Voir également
- Eaux anoxiques
- Benthos
- Zone benthique
- Couche limite benthique
- Cycle biogéochimique
- Sédiments marins
- couche néphéloïde
- Fond marin
- Transport de sédiments
Références
- (en) Peter Santschi, Patrick Höhener, Gaboury Benoit et Marilyn Buchholtz-ten Brink, « Chemical processes at the sediment-water interface », Marine Chemistry, vol. 30, , p. 269–315 (DOI 10.1016/0304-4203(90)90076-o)
- (en) Jens K. Gundersen et Bo Barker Jorgensen, « Microstructure of diffusive boundary layers and the oxygen uptake of the sea floor », Nature, vol. 345, no 6276, , p. 604–607 (ISSN 1476-4687, DOI 10.1038/345604a0, Bibcode 1990Natur.345..604G)
- (en) Jorge Louis Sarmiento et Nicolas Gruber, Ocean Biogeochemical Dynamics, (ISBN 978-0-691-01707-5, OCLC 60651167, présentation en ligne).
- (en) Matthew C. Phillips, Helena M. Solo-Gabriele, Adrianus J. H. M. Reniers et John D. Wang, « Pore Water Transport of Enterococci out of Beach Sediments », Marine Pollution Bulletin, vol. 62, no 11, , p. 2293–2298 (ISSN 0025-326X, PMID 21945015, PMCID 3202074, DOI 10.1016/j.marpolbul.2011.08.049).
- (en) Ashish J. Mehta et Emmanuel Partheniades, « Resuspension of Deposited Cohesive Sediment Beds », Coastal Engineering 1982, , p. 1569–1588 (ISBN 9780872623736, DOI 10.1061/9780872623736.095).
- (en) Murray K. Gingras, S. George Pemberton et Michael Smith, « Bioturbation: Reworking Sediments for Better or Worse », Oilfield Review, vol. 26, no 4, , p. 46–58 (lire en ligne [PDF]).
- (en) T.J. Tolhurst, G. Gust et D.M. Paterson, « The influence of an extracellular polymeric substance (EPS) on cohesive sediment stability », dans Fine Sediment Dynamics in the Marine Environment, vol. 5, coll. « Proceedings in Marine Science », , 409–425 p. (ISBN 9780444511362, DOI 10.1016/s1568-2692(02)80030-4)
- (en) Jeffrey L. Bada, « The transition from abiotic to biotic chemistry: When and where? », American Geophysical Union, Fall Meeting 2001, (résumé).
- (en) Gardner, Wayne, Lee, G. Fred, « Oxygenation of Lake Sediments », International Journal of Air and Water Pollution, vol. 9, , p. 553–564 (lire en ligne)
- (en) « NetLogo Models Library: Solid Diffusion », sur ccl.northwestern.edu (consulté le ).
- (en) René P. Schwarzenbach, Philip M. Gschwend et Dieter M. Imboden, Environmental Organic Chemistry, John Wiley & Sons, (ISBN 978-1-118-76704-7, lire en ligne)
- (en) Robert G. Wetzel, Limnology : Lake and River Ecosystems, Academic Imprint, , 3e éd. (ISBN 978-0-12-744760-5, DOI 10.1016/c2009-0-02112-6, lire en ligne).
- (en) Matthew J. Hoostal et Juan L. Bouzat, « The Modulating Role of Dissolved Organic Matter on Spatial Patterns of Microbial Metabolism in Lake Erie Sediments », Microbial Ecology, vol. 55, no 2, , p. 358–368 (ISSN 1432-184X, DOI 10.1007/s00248-007-9281-7, lire en ligne).