Intéine
Une intéine est une séquence d'acides aminés d'une protéine qui peut se découper elle-même (autocatalyse) et recombiner les morceaux restants (extéines) par une liaison peptidique. Comme certaines intéines contiennent également une endonucléase, leurs gènes codants sont une forme d'ADN égoïste[1].
Caractéristiques
À ce jour, des intéines ont été trouvées dans les trois domaines (super-riches) de la vie (eucaryotes, bactéries et archées), ainsi que chez les virus. En 2014, on connaît plus de 116 intrants chez les eucaryotes, 1137 chez les bactéries, 381 chez les archées et 243 chez les virus, y compris les bactériophages[2]. En 2002, il y en avait 113 dans les eucaryotes, 289 dans les bactéries, 182 dans les archées et seulement 2 dans les virus en 2005[3] - [4]. Les longueurs varient entre 138 et 844 acides aminés. La plupart des intéines contiennent un domaine endonucléase qui joue un rôle dans la prolifération des intéines. L'endonucléase ne clive que les allèles sans intéine du gène contenant l'intéine (sur le chromosome homologue), ce qui entraîne, lors de la réparation de la cassure double brin, l'introduction de l'ADN codant pour l'inteine dans cette coupure par le système de réparation de l'ADN. Grâce à ce processus, l'intéine a été multipliée et la cellule est homozygote pour le gène contenant l'inteine, ce qui fait que lors de la division cellulaire, l'inteine est automatiquement multipliée à toutes les cellules filles. C'est pourquoi les protéines (ou plutôt les segments de gènes qui codent pour les protéines) sont appelées "éléments génétiques égoïstes". Il serait toutefois plus précis de les qualifier de parasites.
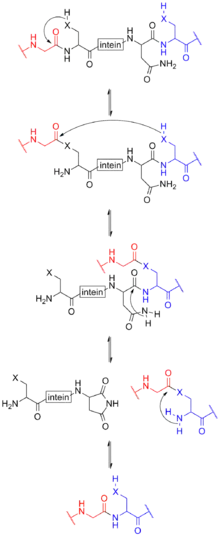
Par analogie avec les séquences d'ARN découpées lors de l'épissage, les intéines sont également appelées introns protéiques, autoprotéolyse et relégation en tant qu'épissage protéique[5]. Trois mécanismes dans les intéines ont été décrits jusqu'à présent[6].
L'épissage des protéines médié par l'intéine se produit après la traduction de l'ARNm en une protéine. Cette protéine précurseur contient au moins trois segments : une N-extéine, une intéine et une C-extéine. Après le processus d'épissage, le résultat est également appelé extéine.
Dénomination
La première partie du nom d'une protéine est constituée du nom scientifique de l'organisme dans lequel elle a été trouvée. La deuxième partie est basée sur le gène ou l'extein dans lequel il est présent. Par exemple, la deuxième inteinte de Thermococcus fumicolans dans le gène de l'ADN polymérase serait désignée Tfu Pol-2. Les intéines sont numérotées à partir de l'extrémité 5' du gène.
Intéines séparées
Dans certains cas, les intéines d'une protéine précurseur sont situées sur des gènes différents. On parle ici d'inteins séparés (anglais : split inteins). Un exemple est la sous-unité catalytique alpha de l'ADN polymérase III chez les cyanobactéries, comme Synechocystis sp. (désignation Ssp DnaE). La protéine de la DnaE est codée par deux gènes distants de plus de 700 kbp. L'un contient l'extrémité N -terminale (dnaE-n) et une séquence d'intéine de 123 acides aminés, et le second code pour une deuxième séquence d'une protéine de 36 AS et l'extrémité C-terminale (dnaE-c). Par transépissage, les deux parties de la protéine sont réunies en une protéine fonctionnelle.
Applications
Les intéines sont utilisées en biotechnologie, par exemple lors de la synthèse des protéines, pour marquer sélectivement des segments de protéines au cours d'un marquage moléculaire, par exemple avec des atomes lourds. Cela est utile pour l'étude de grandes protéines par RMN. En outre, les polypeptides peuvent être liés entre eux (ligature des protéines). Il devient ainsi possible, entre autres, d'exprimer des protéines cytotoxiques, de réaliser des cyclisations (pour augmenter la stabilité) et d'examiner les structures protéiques. Certaines intéines peuvent être déclenchées par des thiols ou en abaissant le pH[7] - [8] - [9].
Historique
La première intéine a été découverte en 1988 grâce à une comparaison de séquences des ATPases de Neurospora crassa, de la carotte et de la levure de boulanger[10] - [11]. La séquence de l'intéine a été classée par erreur comme transporteur d'ions calcium[12]. En 1990, la perte de la séquence de l'intéine après traduction a été décrite[13].
Notes et références
- (de) Skander Elleuche et Stefanie Pöggeler, « Proteinspleißen: Inteine – die “Introns” der Proteine und ihre biotechnologische Anwendung », Biologie in unserer Zeit, vol. 36, no 5, , p. 294–301 (ISSN 0045-205X et 1521-415X, DOI 10.1002/biuz.200610314, lire en ligne, consulté le )
- (en) Olga Novikova, Natalya Topilina et Marlene Belfort, « Enigmatic Distribution, Evolution, and Function of Inteins », Journal of Biological Chemistry, vol. 289, no 21, , p. 14490–14497 (PMID 24695741, PMCID PMC4031506, DOI 10.1074/jbc.R114.548255, lire en ligne, consulté le )
- « InBase unavailable »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur tools.neb.com (consulté le )
- (en) Hiroyuki Ogata, Didier Raoult et Jean-Michel Claverie, « A new example of viral intein in Mimivirus », Virology Journal, vol. 2, no 1, (ISSN 1743-422X, PMID 15707490, PMCID PMC549080, DOI 10.1186/1743-422X-2-8, lire en ligne, consulté le )
- Yasuhiro Anraku, Ryuta Mizutani et Yoshinori Satow, « Protein Splicing: Its Discovery and Structural Insight into Novel Chemical Mechanisms », IUBMB Life (International Union of Biochemistry and Molecular Biology: Life), vol. 57, no 8, , p. 563–574 (ISSN 1521-6543 et 1521-6551, DOI 10.1080/15216540500215499, lire en ligne, consulté le )
- (en) Gerrit Volkmann et Henning D. Mootz, « Recent progress in intein research: from mechanism to directed evolution and applications », Cellular and Molecular Life Sciences, vol. 70, no 7, , p. 1185–1206 (ISSN 1420-682X et 1420-9071, DOI 10.1007/s00018-012-1120-4, lire en ligne, consulté le )
- S. Chong, F. B. Mersha, D. G. Comb et M. E. Scott, « Single-column purification of free recombinant proteins using a self-cleavable affinity tag derived from a protein splicing element », Gene, vol. 192, no 2, , p. 271–281 (ISSN 0378-1119, PMID 9224900, DOI 10.1016/s0378-1119(97)00105-4, lire en ligne, consulté le )
- S. Chong, G. E. Montello, A. Zhang et E. J. Cantor, « Utilizing the C-terminal cleavage activity of a protein splicing element to purify recombinant proteins in a single chromatographic step », Nucleic Acids Research, vol. 26, no 22, , p. 5109–5115 (ISSN 0305-1048, PMID 9801307, PMCID PMC147948, DOI 10.1093/nar/26.22.5109, lire en ligne, consulté le )
- D. W. Wood, W. Wu, G. Belfort et V. Derbyshire, « A genetic system yields self-cleaving inteins for bioseparations », Nature Biotechnology, vol. 17, no 9, , p. 889–892 (ISSN 1087-0156, PMID 10471931, DOI 10.1038/12879, lire en ligne, consulté le )
- E. J. Bowman, K. Tenney et B. J. Bowman, « Isolation of genes encoding the Neurospora vacuolar ATPase. Analysis of vma-1 encoding the 67-kDa subunit reveals homology to other ATPases », The Journal of Biological Chemistry, vol. 263, no 28, , p. 13994–14001 (ISSN 0021-9258, PMID 2971651, lire en ligne, consulté le )
- L. Zimniak, P. Dittrich, J. P. Gogarten et H. Kibak, « The cDNA sequence of the 69-kDa subunit of the carrot vacuolar H+-ATPase. Homology to the beta-chain of F0F1-ATPases », The Journal of Biological Chemistry, vol. 263, no 19, , p. 9102–9112 (ISSN 0021-9258, PMID 2897965, lire en ligne, consulté le )
- C. K. Shih, R. Wagner, S. Feinstein et C. Kanik-Ennulat, « A dominant trifluoperazine resistance gene from Saccharomyces cerevisiae has homology with F0F1 ATP synthase and confers calcium-sensitive growth », Molecular and Cellular Biology, vol. 8, no 8, , p. 3094–3103 (ISSN 0270-7306, PMID 2905423, PMCID PMC363536, DOI 10.1128/mcb.8.8.3094-3103.1988, lire en ligne, consulté le )
- R. Hirata, Y. Ohsumk, A. Nakano et H. Kawasaki, « Molecular structure of a gene, VMA1, encoding the catalytic subunit of H(+)-translocating adenosine triphosphatase from vacuolar membranes of Saccharomyces cerevisiae », The Journal of Biological Chemistry, vol. 265, no 12, , p. 6726–6733 (ISSN 0021-9258, PMID 2139027, lire en ligne, consulté le )