Hexachlorure de tungstène
L'hexachlorure de tungstène, ou chlorure de tungstène(VI), est un composé chimique de formule WCl6. Il se présente comme un solide volatil de couleur bleu-violet foncé à géométrie moléculaire octaédrique dont les molécules présentent des liaisons W–Cl longues de 224 à 226 pm[3]. L'hexafluorure de tungstène WF6 est mieux connu, et plus volatil. Les dérivés du tungstène (VI) sont diamagnétiques.
| Hexachlorure de tungstène | |
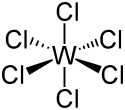 Structure de l'hexachlorure de tungstène |
|
| Identification | |
|---|---|
| Nom UICPA | hexachlorotungstène |
| No CAS | |
| No ECHA | 100.032.980 |
| No CE | 236-293-9 |
| No RTECS | YO7710000 |
| PubChem | 83301 |
| ChEBI | 37771 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | Cl6W |
| Masse molaire[1] | 396,56 ± 0,02 g/mol Cl 53,64 %, W 46,36 %, |
| Propriétés physiques | |
| T° fusion | 275 °C[2] |
| T° ébullition | 347 °C[2] |
| Solubilité | décomposition dans l'eau[2] |
| Masse volumique | 3,52 g·cm-3[2] |
| Précautions | |
| SGH[2] | |
 Danger |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
On le prépare par chloration directe du tungstène métallique en tube scellé à 600 °C[4] :
À température ambiante, l'hexachlorure de tungstène présente une couleur foncée tirant sur le bleu-violet, mais vire au bordeaux aux températures inférieures. Il présente une teinte rouge lorsqu'il est condensé rapidement à partir de sa vapeur, et reprend sa teinte bleu-violet foncé par léger chauffage. Il est soluble dans le disulfure de carbone CS2, le tétrachlorométhane CCl4 et le trichlorure de phosphoryle POCl3[4]. Il s'hydrolyse facilement au contact de l'humidité de l'air en donnant des oxychlorures orange WOCl4 et WO2Cl2 puis le trioxyde de tungstène WO3.
La méthylation avec le triméthylaluminium Al2(CH3)6 donne de l'hexaméthyltungstène W(CH3)6 :
Le traitement avec le n-butyllithium donne un réactif qui est utile pour la désoxygénation des époxydes [4].
Les ligands chlorure du WCl6 peuvent être remplacés par de nombreux ligands anioniques tels que Br−, SCN−, et RO− (R = alkyle, aryle).
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Tungsten(VI) chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 novembre 2013 (JavaScript nécessaire)
- (en) J. C. Taylor et P. W. Wilson, « The structure of β-tungsten hexachloride by powder neutron and X-ray diffraction », Acta Crystallographica Section B – Structural Crystallography and Crystal Chemistry, vol. 30, no 5, , p. 1216-1220 (lire en ligne) DOI 10.1107/S0567740874004572
- (en) Ludwig F. Audrieth, Inorganic Syntheses, McGraw-Hill Book Company, (ISBN 9780470131626), p. 165
