Hélianthine
L'hélianthine, autrement appelée méthylorange (MO), orangé III[5] ou encore orangé de méthyle, est un indicateur coloré utilisé en chimie pour marquer la présence d'un milieu acide (il vire en rose-rouge) ou d'un milieu basique (il vire en jaune-orangé). La modification du système conjugué par la protonation de la double liaison provoque un changement du maximum d'absorption. On l'utilise donc pour les dosages acido-basiques.
| Hélianthine[1] - [2] | |
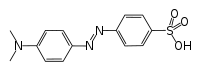
| |
| Formule topologique de l'hélianthine | |
| Identification | |
|---|---|
| Nom UICPA | acide 4-{(E)-[4-(diméthylamino)phényl]diazényl}benzènesulfonique (forme acide) 4-{(E)-[4-(diméthylamino)phényl]diazényl}benzènesulfonate de sodium (sel de sodium) |
| Synonymes |
C.I. 13025 |
| No CAS | |
| No ECHA | 100.008.115 |
| No CE | 208-925-3 |
| SMILES | |
| InChI | |
| Apparence | cristaux orange |
| Propriétés chimiques | |
| Formule | forme acide : C14H15N3O3S [Isomères] 305,353949 g∙mol-1 sel de sodium : C14H14N3NaO3S 327,335778 g∙mol-1 |
| pKa | 3,39[3] |
| Propriétés physiques | |
| Solubilité | 5,20 g l−1 dans l'eau à 20 °C |
| Précautions | |
| SIMDUT[4] | |
Produit non contrôlé |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Sa formule chimique est C14H14N3O3S−,Na+ lorsqu'il est sous forme de sel. Le couple acide-base correspondant est NH2-Phen-N=N-Phen-SO3− / NH+2-Phen-N-NH-Phen-SO3−. Le pKa de ce couple est 3,39.
Son nom date du XIXe siècle et emprunte à la plante hélianthe[5] (du latin helianthus - du grec hêlios, « soleil », et anthos, « fleur »).
Couleurs de l'indicateur
Synthèse
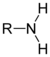
Une synthèse possible consiste à faire évoluer une amine primaire (R-NH2) en diazonium (R-NN+) stable lorsque R est un dérivé benzénique. Cet ion diazonium est très réactif et permet de synthétiser de nombreux colorants azoïques et en particulier l'hélianthine, en choisissant de façon adéquate les substituants des divers réactifs.
Cette réaction peut se décomposer de façon schématique en deux étapes principales :
- une première étape où l'on transforme l'amine primaire en ion diazonium par l'action de l'acide nitreux. Ce dernier étant particulièrement instable, on utilise en fait le nitrite de sodium (Na+, NO2−) en milieu acide :
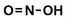 +
+  + H+ =
+ H+ = 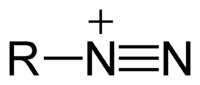 + 2 H2O
+ 2 H2O
- la seconde étape fait réagir le cation diazonium substitué avec un dérivé benzénique par substitution électrophile aromatique :
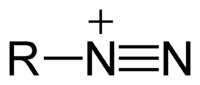 + H-R’ = R-N=N-R’ + H+
+ H-R’ = R-N=N-R’ + H+
Dans notre cas, on choisit R = HO3S-Ph et R’ = Ph-N(CH3)2 pour former l'hélianthine.
Galerie
 Hélianthine en poudre.
Hélianthine en poudre. Échelle de teintes de l'hélianthine (de gauche à droite : pH croissant).
Échelle de teintes de l'hélianthine (de gauche à droite : pH croissant).
Notes et références
- Sauf indication contraire, les données du tableau concernent la forme basique (sel de sodium) de l'hélianthine
- Fiche de Données de Sécurité Panreac
- (en) David R. Line, Handbook of Chemistry and Physics, 84e éd., 2003/2004, CRC Press, 2004
- « C.I. acid orange 52 » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Hélianthine, sur www.larousse.fr