Diacétate d'iodobenzène
Le diacétate d'iodobenzène, (diacétoxyiodo)benzène, diacetate de phényliode ou encore PIDA (de l'anglais PhenylIodine DiAceteate), est un periodinane, un composé organique hypervalent de l'iode(III) (iodinane λ3).
| Diacétate d'iodobenzène | |
benzene.svg.png.webp)
| |
| Identification | |
|---|---|
| Nom UICPA | bis(acétyloxy)(phényl)-λ3-iodane |
| Synonymes |
diacétate d'iodosobenzène |
| No CAS | |
| No ECHA | 100.019.826 |
| No CE | 221-808-1 |
| No RTECS | DA3525000 |
| PubChem | 76724 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C10H11IO4 [Isomères] |
| Masse molaire[1] | 322,096 4 ± 0,01 g/mol C 37,29 %, H 3,44 %, I 39,4 %, O 19,87 %, |
| Propriétés physiques | |
| T° fusion | 161-163 °C[2] |
| Précautions | |
| Directive 67/548/EEC[2] - [3] | |
 Xn  Xi |
|
| Écotoxicologie | |
| DL50 | 56 mg·kg-1 (souris, i.v.)[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
Il est possible de le préparer par oxydation de l'iodobenzène par l'acide peracétique et l'acide acétique[5] :
Utilisation
Le diacétate d'iodobenzène est un réactif chimique polyvalent, utilisé principalement comme oxydant. Il peut, par exemple, être utilisé pour oxyder des alcools[6] ou dans l'aziridination d'alcènes avec des sulfamates, catalysée par du rhodium[2]. De fait, ce réactif est utile pour la synthèse d'une grande variété de composés hétérocycliques[2].
Le diacétate d'iodobenzène est également utilisé dans la synthèse d'acétals à 5 ou 6 chaînons à partir de β-hydroxyéthers et γ-hydroxyéthers via une voie photochimique[7].
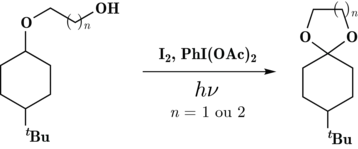
Cette réaction photochimique a été utilisée de nombreuses fois dans le but de synthétiser des produits naturels[8].
Il est aussi utilisé pour cliver les glycols et les α-hydroxycétones dans des réactions d'ouverture de cycle et la réaction de Mannich.
Il peut également être hydrolysé en iodoxybenzène (iodylbenzène) C6H5O2I [9], ou encore en iodosobenzène en présence d'hydroxyde de sodium[10].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (Diacetoxyiodo)benzene chez Sigma-Aldrich.
- Iodobenzene Diacetate chez TCI Europe.
- (en) « Diacétate d'iodobenzène », sur ChemIDplus.
- J. G. Sharefkin and H. Saltzman, Benzene, iodoso-, diacetate, Org. Synth., coll. « vol. 5 », p. 660
- G. Piancatelli, F. Leonelli, Oxidation of nerol to neral with iodobenzene diacetate et TEMPO, Org. Synth., 2006, vol. 83, p. 18.
- (en) Kyoji Furuta, Takushi Nagata et Hisashi Yamamoto, « A direct synthesis of cyclic acetals from β- or γ-hydroxy ethersby means of C-H activation », Tetrahedron Letters, vol. 29, no 18, , p. 2215–2218 (DOI 10.1016/S0040-4039(00)86715-5, lire en ligne, consulté le )
- (en) Jonathan Sperry, Yen-Cheng (William) Liu et Margaret A. Brimble, « Synthesis of natural products containing spiroketals via intramolecular hydrogen abstraction », Org. Biomol. Chem., vol. 8, no 1, , p. 29–38 (ISSN 1477-0520 et 1477-0539, DOI 10.1039/B916041H, lire en ligne, consulté le )
- J. G. Sharefkin and H. Saltzman, Benzene, iodoxy-, Org. Synth., coll. « vol. 5 », p. 665
- H. Saltzman and J. G. Sharefkin, Benzene, iodoso-, Org. Synth., coll. « vol. 5 », p. 658