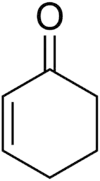
Cyclohexénone
La cyclohexénone est un composé organique cyclique de formule C6H8O. C'est un intermédiaire usuel en synthèse organique pour un grand nombre de produits chimiques, composés pharmaceutiques ou parfums[6]. Elle se présente sous la forme d'un liquide brun foncé de point d'ébullition de 171 à 173 °C.
| Cyclohexénone | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | cyclohex-2-én-1-one | ||
| No CAS | |||
| No ECHA | 100.012.021 | ||
| No CE | 213-223-5 | ||
| No RTECS | GW7000000 | ||
| PubChem | 13594 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide marron foncé[1] | ||
| Propriétés chimiques | |||
| Formule | C6H8O [Isomères] |
||
| Masse molaire[2] | 96,127 1 ± 0,005 7 g/mol C 74,97 %, H 8,39 %, O 16,64 %, |
||
| Propriétés physiques | |||
| T° fusion | −53 °C[1] | ||
| T° ébullition | 171 à 173 °C[1] | ||
| Solubilité | 36,2 g·l-1 (eau, 25 °C)[3] | ||
| Masse volumique | 0,993 g·cm-3 (25 °C)[1] | ||
| Point d’éclair | 56 °C (coupelle fermée)[1] | ||
| Pression de vapeur saturante | 3,620 mmHg (25 °C)[3] 1,013 hPa (168 °C)[1] |
||
| Précautions | |||
| SGH[1] | |||
  |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 170 mg/kg (souris, intrapéritonéal)[4] |
||
| CL50 | 250ppm/4H (rat, inhalation)[5] | ||
| LogP | 0,61[3] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Synthèse
La cyclohexénone peut être synthétisée de différentes façons.
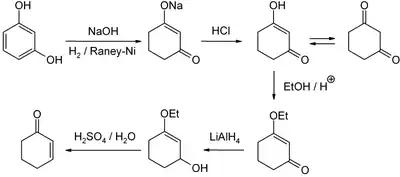
En laboratoire, une méthode à présent bien développée est la réduction et l'hydrolyse acide de la 3-éthoxy-2-cyclohexéne-1-one, qui peut quant à elle être obtenue à partir du résorcinol ou de la cyclohexane-1,3-dione :
 .
.
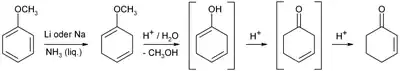
On peut aussi faire réagir l'anisole dans l'ammoniaque par réduction de Birch suivie d'une hydrolyse acide et d'un réarrangement de la double liaison C-C créée :
 .
.
Il est également possible de faire réagir la cyclohexanone par α-bromation puis élimination, ou encore le 3-chlorocyclohexène par hydrolyse et oxydation.
Dans l'industrie, la cyclohexénone est préparée à partir du phénol par réduction de Birch[7], ou par oxydation catalytique du cyclohexène, par exemple avec du peroxyde d'hydrogène sur un catalyseur au vanadium, de nomreuses méthodes avec différents oxydants et catalyseurs ayant été brevetées.
Réactivité
La cyclohexénone est souvent utilisée dans les additions nucléophiles conjuguées avec les organocuprates, dans les additions de Michael et les annélations de Robinson[8] - [9].
Notes et références
- Fiche Sigma-Aldrich du composé 2-Cyclohexen-1-one, consultée le 27 septembre 2012.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Cyclohexénone », sur ChemIDplus, consulté le 27 septembre 2012
- Personal Communication from H. Zollner, Institut fur Biochemie, Der Universitat, Gras, 23 octobre 1975, vol. 23OCT1975
- American Industrial Hygiene Association Journal. vol. 33, p. 338, 1972, [www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Search&db=PubMed&term=4649066 Pubmed]
- Podraze, K.F. Org. Prep. Proced. Int., 1991, 23, p. 217.
- Organic Building Blocks of the Chemical Industry, Harry H. Szmant, (ISBN 978-0-471-85545-3)
- (en) Michael G. Organ et Paul Anderson, « Carbonyl and Conjugate Additions to Cyclohexenone: Experiments Illustrating Reagent Selectivity », Journal of Chemical Education, vol. 73, no 12, , p. 1 193 (DOI 10.1021/ed073p1193)
- Tet. Lett. 34, 3881, (1993)
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Cyclohexenone » (voir la liste des auteurs) et en allemand « 2-Cyclohexen-1-on » (voir la liste des auteurs).

