Annélation de Robinson
En chimie organique, l'annélation de Robinson est une réaction qui créé une cétone α,β-insaturée cyclique à 6 membres à partir d'une cétone (ou aldéhyde) et de la méthylvinylcétone[1] - [2] - [3]. La réaction tient son nom du chimiste britannique Robert Robinson qui l'a découverte à l'université d'Oxford.
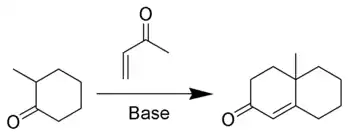
Mécanisme
La méthylvinylcétone (ou ses dérivés) est un réactif essentiel de la réaction puisqu'elle est à la fois un accepteur de Michael et qu'elle peut prendre part à une condensation aldolique. La première étape de l'annélation est une addition de Michael suivie par une addition aldolique comme étape de cyclisation. La réaction continue par une étape de déshydratation comme dans une condensation aldolique classique pour former le cycle cyclohexénone.
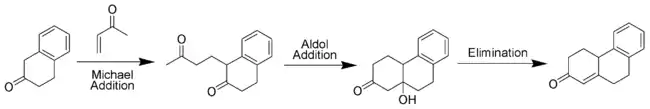
Variantes
Annélation de Robinson asymétrique
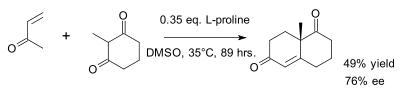
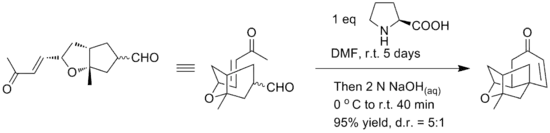
L'original de Wieland-Miescher cétone est racémique et préparé dans une annélation de Robinson du 2-méthylcyclohexane-1,3-dione et la méthyl vinyl cétone[4]. L'annélation de Robinson peut être rendue stéréoselective par l'ajout de L- ou D-proline[5].
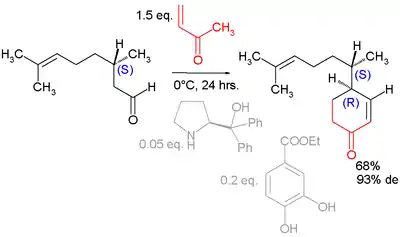
Des dérivés de la proline peuvent aussi être utilisés comme pour cette annélation asymétrique du géranial[6] :
Réaction de Wichterle
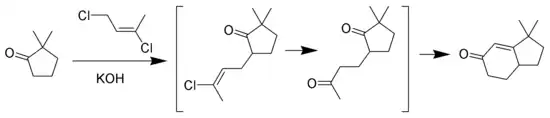
La réaction de Wichterle est une variante de l'annélation de Robinson où la méthylvinylcétone est remplacée par le E-1,3-dichlorobut-2-ène[7] - [8] - [9].
Annélation de Hauser
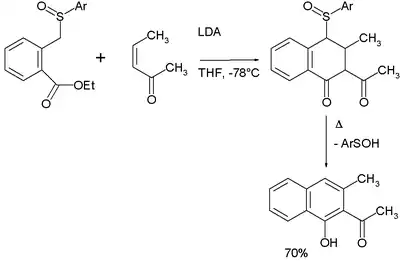
La séquence réactionnelle de l'annélation de Hauser est addition de Michael - condensation de Dieckman - élimination[10].
Applications
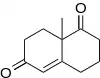
La cétone de Wieland-Miescher est le produit de l'annélation de Robinson de la 2-méthylcyclohexane-1,3-dione et de la méthylvinylcétone(racémique) alors que la cétone de Hajos-Parrish est le produit de la réaction de la 2-méthylcyclohexane-1,3-dione et de la méthylvinylcétone catalysé par la D-proline [11].
Synthèse énantiomérosélective de la platensimycine
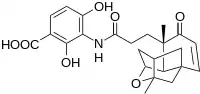
Des scientifiques de l'entreprise pharmaceutique Merck ont récemment découvert un nouveau composant aux propriétés antibiotiques pouvant potentiellement avoir des applications médicales, la platensimycine, représentée à droite.
La synthèse première conduisait à un mélange racémique du composé mettant en jeu une réaction d'estérification intramoléculaire entre le groupement alcool et la liaison double. Yamamoto a reporté l'utilisation d'une réaction alternative: une annélation de Robinson intramoléculaire qui fournit une synthèse énantiomérosélective du cœur constitué de quatre cycles de la platensimycin. L'avantage de cette étape d'annélation de Robinson serait d'être réalisé en une étape en utilisant une L-proline pour le contrôle chiral. La réaction est décrite ci-dessous[12].
Notes et références
- (en) W. S. Rapson et R. Robinson, « Experiments on the synthesis of substances related to the sterols. Part II. A new general method for the synthesis of substituted cyclohexenones », J. Chem. Soc., , p. 1285-1288 (ISSN 0368-1769, DOI 10.1039/JR9350001285).
- (en) E. D. Bergmann, D. Ginsburg et al., Organic Reactions, vol. 10, John Wiley & Sons, , 569 p. (ISBN 978-0-471-00759-3, DOI 10.1002/0471264180.or010.03), chap. 3 (« The Michael Reaction »).
- (en) R. E. Gawley, « The Robinson Annelation and Related Reactions », Synthesis, no 12, , p. 777-794 (ISSN 0039-7881, DOI 10.1055/s-1976-24200).
- (de) P. Wieland et K. Miescher, « Über die Herstellung mehrkerniger Ketone », Helv. Chim. Acta, vol. 33, no 7, , p. 2215–2228 (ISSN 0018-019X, DOI 10.1002/hlca.19500330730).
- Hajos, Zoltan G., Parrish, David R. le brevet allemand DE 2102623 (29 juillet 1971) et USP 3.975.440 (Aug.17, 1976) Exemple 21.
- (en) K. C. Nicolaou, D. Sarlah et al., « Total Synthesis and Revised Structure of BiyouyanaginA », Angew. Chem. Int. Ed., vol. 46, no 25, , p. 4708–4711 (ISSN 1433-7851, DOI 10.1002/anie.200701552).
- O. Wichterle, J. Procházka et al., « L'acétylacétate γ-chlorocrotylé et sa cyclisation par l'acide sulfurique », Coll. Czech. Chem. Commun., vol. 13, , p. 300-315 (ISSN 0010-0765, DOI 10.1135/cccc19480300).
- (de) M. Kobayashi et T. Matsumoto, « Modipizierte Wichterle Reaktion. Ein Neuer Weg Zur Synthese Von Δ2-Cyclohexenonen », Chem. Lett., vol. 2, no 9, , p. 957-960 (ISSN 0366-7022, DOI 10.1246/cl.1973.957).
- (en) R. L. Augustine et J. A. Caputo, « Δ1(9)-Octalone-2 », Org. Synth., vol. 45, , p. 80 (ISSN 0078-6209, DOI 10.15227/orgsyn.045.0080).
- (en) D. Mal et P. Pahari, « Recent Advances in the Hauser Annulation », Chem. Rev., vol. 107, no 5, , p. 1892-1918 (ISSN 0009-2665, DOI 10.1021/cr068398q).
- (en) Z. G. Hajos et D. R. Parrish, « Asymmetric synthesis of bicyclic intermediates of natural product chemistry », J. Org. Chem., vol. 39, no 12, , p. 1615-1621 (ISSN 0022-3263, DOI 10.1021/jo00925a003).
- (en) P. Li, J. N. Payette et al., « Enantioselective Route to Platensimycin: An Intramolecular Robinson Annulation Approach », J. Am. Chem. Soc., vol. 129, no 31, , p. 9534-9535 (ISSN 0002-7863, DOI 10.1021/ja073547n).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Robinson annulation » (voir la liste des auteurs).
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Robinson-Anellierung » (voir la liste des auteurs).