Bromure d'or(III)
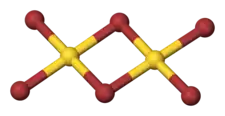
Le bromure d'or(III), ou tribromure d'or, autrefois appelé bromure aurique, est un composé chimique de formule empirique AuBr3 se présentant essentiellement sous forme de dimères Au2Br6. Il se présente comme un solide de couleur rouge sombre cristallisé dans le système monoclinique avec des paramètres a = 6,83 Å, b = 20,4 Å, c = 8,11 Å et β = 119,7°[3].
| Bromure d'or(III) | |
| |
| Dimère de bromure d'or(III) | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.030.582 |
| No CE | 260-763-2 |
| PubChem | 82525 |
| ChEBI | 30079 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | AuBr3 |
| Masse molaire[1] | 436,679 ± 0,003 g/mol Au 45,11 %, Br 54,89 %, |
| Précautions | |
| SGH[2] | |
 Danger |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Structure
La structure du dimère Au2Br6 est semblable à celle des autres trihalogénures dimériques d'or, comme le chlorure d'or(III) Au2Cl6 : l'atome d'or est tétracoordonné avec une géométrie plane carrée formant des angles pratiquement égaux à 90°.
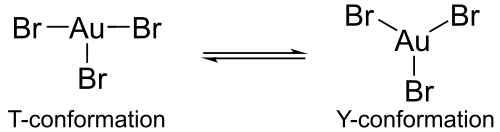
Les calculs montrent que la forme monomérique hypothétique des halogénures d'or(III) AuX3 devrait être affectée par une distorsion Jahn-Teller : le bromure d'or(III) monomérique AuBr3 aurait ainsi une liaison Au–Br longue et deux liaisons courtes, tandis que le chlorure d'or(III) AuCl3 et le fluorure d'or(III) AuF3 monomériques auraient deux liaisons Au–X longues et une liaison courte. De plus, le bromure d'or(III) présente une géométrie de coordination différente de celle des autres halogénures d'or(III) : ces derniers présentent une géométrie en T tandis que le bromure oscille entre une géométrie en T et une géométrie en Y, ce qui explique qu'il soit moins stable que les halogénures d'or(III) plus légers.
Synthèse
La méthode la plus courante pour produire du bromure d'or(III) consiste à chauffer de l'or en présence d'un excès de brome liquide à 140 °C :
Il est également possible de réaliser cette synthèse en traitant du chlorure d'or(III) Au2Cl6 avec du bromure d'hydrogène HBr :
Propriétés chimiques
Le monomère neutre AuBr3 n'a pas été isolé en phase gazeuse, pas plus que le monomère des autres halogénures d'or(III), ce qui indique que la coordinence 3 n'est pas favorisée. C'est donc le dimère qui est observé en solution, avec une coordinence 4.
- 2 AuBr3 → Au2Br6.
À l'état solide, le bromure d'or(III) présente également une coordinence 4, la quatrième position étant occupée par une molécule d'eau dans la forme hydratée AuBr3⋅H2O, de préférence à la forme anhydre, qui serait tricoordonnée.
À l'instar du chlorure d'or(III) Au2Cl6, le bromure d'or(III) est un acide de Lewis et peut former divers complexes, comme l'acide tétrabromaurique HAuBr4 en présence d'acide bromhydrique HBr :
- HBr (aq) + AuBr3 (aq) → H+AuBr4− (aq).
Le dimère est également rapidement hydrolysé à l'air humide.
Applications
Catalyse
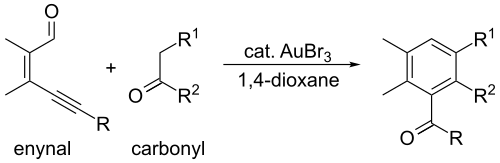
Le bromure d'or(III) est utilisé comme catalyseur dans une grande variété de réactions, l'une des plus intéressantes étant la réaction de Diels-Alder. Plus précisément, ce composé catalyse la réaction entre une unité énynal et des composés à carbonyle pour former un cycle à six atomes :
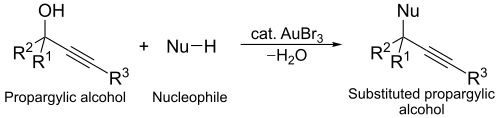
Le bromure d'or(III) est également utilisé pour catalyser la substitution nucléophile d'alcools propargyliques (en) HC≡C–CH2OH. Dans cette réaction, le complexe d'or(III) agit comme un activateur de l'alcool facilitant la substitution.
Détection de stupéfiants
Le bromure d'or(III) peut être utilisé comme réactif pour détecter la présence de stupéfiants comme la kétamine. Une solution de 0,25 % AuBr3 dans 0,1 mol·L-1 NaOH, de couleur jaune-brun, prend une teinte violette intense en présence d'une petite quantité de kétamine en une minute, devenant presque noire en deux minutes environ. Un changement de coloration semblable est observé avec le paracétamol, l'acide ascorbique, l'héroïne, le lactose, le mannitol, la morphine et le saccharose, ainsi qu'avec les composés contenant des groupes phénol et hydroxyle.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Gold(III) bromide 99.9% trace metals basis, consultée le 11 mars 2017.
- (en) Klaus-Peter Lörcher et Joachim Strähle, « The Crystal Structure of Gold(III) Bromide », Zeitschrift für Naturforschung B, vol. 30, nos 9-10, , p. 662-664 (DOI 10.1515/znb-1975-9-1002, lire en ligne)