Bis(triméthylsilyl)acétylène
Le bis(triméthylsilyl)acétylène, ou BTMSA, est un composé chimique de formule (CH3)3Si–C≡C–Si(CH3)3. Il s'agit d'un liquide incolore soluble dans les solvants organiques. On peut le préparer en chauffant de l'acétylène HC≡CH avec du n-butyllithium CH3CH2CH2CH2Li suivi par l'addition de chlorure de triméthylsilyle (CH3)3SiCl. Une autre méthode procède à partir de carbure de calcium CaC2 de qualité suffisante et de chlorure de triméthylsilyle dans une masse fondue de chlorure de lithium LiCl et de chlorure de potassium KCl à 400 °C[4].
acetylen_Synthese.svg.png.webp)
| Bis(triméthylsilyl)acétylène | |||
acetylen.svg.png.webp)
| |||
| Structure du bis(triméthylsilyl)acétylène | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | triméthyl(2-triméthylsilyléthynyl)silane | ||
| Synonymes |
BTMSA |
||
| No CAS | |||
| No ECHA | 100.035.141 | ||
| No CE | 238-671-9 | ||
| PubChem | 84564 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide clair[1] | ||
| Propriétés chimiques | |||
| Formule | C8H18Si2 [Isomères] |
||
| Masse molaire[2] | 170,399 5 ± 0,008 3 g/mol C 56,39 %, H 10,65 %, Si 32,96 %, |
||
| Propriétés physiques | |||
| T° fusion | 20 à 24 °C[1] | ||
| T° ébullition | 136 à 137 °C[1] | ||
| Masse volumique | 0,752 g/mL[3] à 25 °C | ||
| Point d’éclair | 2 °C[1] | ||
| Propriétés optiques | |||
| Indice de réfraction | = 1,4270[1] | ||
| Précautions | |||
| SGH[1] - [3] | |||
  Danger |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Cela convertit le chlorure de triméthylsilyle avec un rendement d'environ 77 % en donnant du BTMSA qui peut facilement être séparé du chlorure de triméthylsilyle qui n'a pas réagi et d'hexaméthyldisiloxane formé comme sous-produit.
Il est utilisé comme nucléophile dans les acylations et alkylations de type Friedel-Crafts et comme précurseur du triméthylsilylacétylure de lithium. Le groupe triméthylsilyle –Si(CH3)3 peut être déplacé par le fluorure de tétra-n-butylammonium (CH3CH2CH2CH2)4N+F− et remplacé par des protons.
Il est également utilisé comme réactif de départ dans la synthèse de 1,2-bis(triméthylsilyl)benzènes fonctionnalisés, qui à leur tour servent de matière de départ pour la synthèse de catalyseurs acides de Lewis et de certains matériaux pour l'éclairage[5]. Dans des réactions catalysées par le cobalt, le bis(triméthylsilyl)acétylène est utilisé pour conférer une chimiosélectivité et une fonctionnalité (sous la forme du groupe triméthylsilyle), ce qui permet la construction de molécules complexes[6].
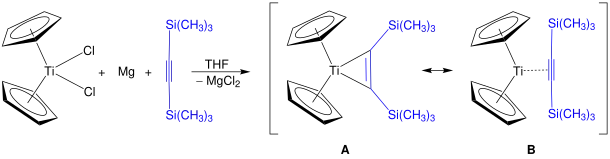
Une autre application importante est à travers le réactif de Rosenthal pour stabiliser les fragments de titanocène Cp2Ti et de zirconocène Cp2Zr[7]. L'utilisation de bis(triméthylsilyl)acétylène comme ligand de métallocènes autrement instables permet la synthèse de structures organiques difficiles, comme des macrocycles et hétérométallacycles (en), de manière sélective et à haut rendement[8] - [9].
Le bis(triméthylsilyl)acétylène est également un réactif utile pour réaliser des cycloadditions. Il a été utilisé pour la synthèse totale de l'estrone, dont l'étape cruciale est la formation du squelette stéroïde catalysée par le dicarbonyle de cyclopentadiénylcobalt (C5H5)Co(CO)2.
Notes et références
- « Fiche du composé Bis(trimethylsilyl)acetylene, 99% », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Bis(triméthylsilyle)acétylène 99 %, consultée le 17 mai 2022.
- (de) Jürgen Stenzel et Wolfgang Sundermeyer, « Chemische Reaktionen in Salzschmelzen, XIV. Über die Darstellung von Bis-trimethylsilyl-carbodiimid und Bis-trimethylsilyl-acetylen », Chemische Berichte, vol. 100, no 10, , p. 3368-3370 (DOI 10.1002/cber.19671001027, lire en ligne)
- (en) Christian Reus, Nai-Wei Liu, Michael Bolte, Hans-Wolfram Lerner et Matthias Wagner, « Synthesis of Bromo-, Boryl-, and Stannyl-Functionalized 1,2-Bis(trimethylsilyl)benzenes via Diels–Alder or C–H Activation Reactions », The Journal of Organic Chemistry, vol. 77, no 7, , p. 3518-3523 (DOI 10.1021/jo3002936, lire en ligne)
- (en) John R. Fritch, K. Peter C. Vollhardt, Michael R. Thompson et Victor W. Day, « Apparent concurrent acetylene-vinylidenecarbene rearrangements, silyl-acetylide metathesis, and alkyne cleavage in the interaction of bis(trimethylsilyl)acetylene with (η5-C5H5)Co(CO)2. Crystal and molecular structure of a novel biscarbyne complex: [μ3η1-CSi(CH3)3][μ3η1-C3Si(CH3)3][(η5-C5H5)Co]3 », Journal of the American Chemical Society, vol. 101, no 10, , p. 2768-2770 (DOI 10.1021/ja00504a065, lire en ligne)
- (en) A. Ohff, S. Pulst, C. Lefeber, N. Peulecke, P. Arndt, V. V. Burkalov et U. Rosenthal, « Unusual Reactions of Titanocene- and Zirconocene-Generating Complexes », Synlett, vol. 1996, no 2, , p. 111-118 (DOI 10.1055/s-1996-5338, lire en ligne)
- (en) Uwe Rosenthal, « Reactions of Group 4 Metallocene Bis(trimethylsilyl)acetylene Complexes with Nitriles and Isonitriles », Angewandte Chemie International Edition, vol. 57, no 45, , p. 14718-14735 (DOI 10.1002/anie.201805157, lire en ligne)
- (en) Jonathan R. Nitschke, Stefan Zürcher et T. Don Tilley, « New Zirconocene-Coupling Route to Large, Functionalized Macrocycles », Journal of the American Chemical Society, vol. 122, no 42, , p. 10345-10352 (DOI 10.1021/ja0020310, lire en ligne)


