Bendamustine
La bendamustine est un médicament de chimiothérapie utilisé dans le traitement de la leucémie myéloïde chronique, des myélomes multiples, et du lymphome non-Hodgkinien. Elle est commercialisée sous le nom Levact en France, et Treanda, Treakisym, Ribomustin dans le reste du monde.
| Bendamustine | |
| |
| Identification | |
|---|---|
| No ECHA | 100.205.789 |
| PubChem | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
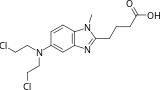
| Formule | C16H21Cl2N3O2 |
| Masse molaire[1] | 358,263 ± 0,019 g/mol C 53,64 %, H 5,91 %, Cl 19,79 %, N 11,73 %, O 8,93 %, |
| Données pharmacocinétiques | |
| Biodisponibilité | Injection intraveineuse uniquement |
| Liaison protéique | 94–96 % |
| Métabolisme | Hydrolysé en métabolites inactifs. Deux métabolites mineurs (M3 et M4) sont formés par le CYP1A2 |
| Demi-vie d’élim. | 40 min (bendamustine), 3 h (M3), 30 min (M4) |
| Excrétion |
~50 % urinaire, ~25 % fécale [2] |
| Considérations thérapeutiques | |
| Voie d’administration | Injection intraveineuse |
| Grossesse | Contre-indiqué |
| Unités du SI et CNTP, sauf indication contraire. | |
.png.webp)
Indication
La bendamustine a reçu l’AMM dans le traitement :
- De première ligne de la leucémie lymphoïde chronique (stade Binet B ou C) des patients chez qui une polychimiothérapie comportant de la fludarabine n'est pas appropriée, et principalement en association à d’autres molécules comme le rituximab. Son utilisation en monothérapie (dans le cadre de son indication validée par l’AMM) est devenue restreinte dans cette situation ;
- En monothérapie en 2e intention du lymphome non hodgkinien indolent chez des patients qui ont progressé pendant ou dans les 6 mois qui suivent un traitement par rituximab seul ou en association.
- De première ligne du myélome multiple (stade II en progression ou stade III de la classification de Durie-Salmon) en association avec la prednisone chez des patients de plus de 65 ans qui ne sont pas éligibles pour la greffe autologue de cellules souches et qui présentent une neuropathie au moment du diagnostic excluant l'utilisation de traitement comportant du thalidomide ou du bortezomib[3].
Usage
La bendamustine est notamment utilisée en combinaison avec l'etoposide, la fludarabine, la mitoxantrone, le méthotrexate, la prednisone, le rituximab, ou la vincristine.
Pharmacologie
Mécanisme d'action
La bendamustine est un agent alkylant interférant avec la synthèse de l'ADN et de l'ARN, provoquant des liaisons croisées (« cross-linking ») intra-brin et inter-brin entre les bases de l'ADN..
Pharmacocinétique
Après injection intraveineuse, elle est largement métabolisé dans le foie par le CYP1A2. Plus de 95 % du médicament est lié aux protéines, principalement à l'albumine. Seule la bendamustine libre est active. L'élimination est biphasique avec une demi-vie de 6 à 10 minutes et une demi-vie terminale d'environ 30 minutes. Elle est éliminée principalement par les reins.
Chimie
La bendamustine est une poudre microcristalline blanche hydrosoluble aux propriétés amphotères.
Historique
La bendamustine a été synthétisée pour la première fois en 1963 par Ozegowski et Krebs en République Démocratique Allemande[4]. Jusqu'en 1990, ce n'était disponible qu'en Allemagne de l'Est, où des chercheurs avaient découvert son efficacité dans le traitement de la leucémie lymphoïde chronique, la maladie de Hodgkin, le lymphome non hodgkinien, le myélome multiple et le cancer du poumon.
La bendamustine a été récupérée pour commercialisation après l'annexion de l'Allemagne de l'Est par l'ouest, où elle est commercialisée sous le nom Ribomustin, par Astellas Pharma qui s'en est approprié la licence.
En mars 2008, Cephalon a reçu l'approbation de la Food and Drug Administration des États-Unis pour commercialiser la bendamustine aux États-Unis, où elle est vendue sous le nom nom commercial Treanda, pour le traitement de la leucémie lymphoïde chronique[5].
En octobre 2008, la FDA a accordé une nouvelle approbation pour commercialiser Treanda pour le traitement du lymphome non hodgkinien indolent à cellules B[6].
Elle a reçu en France son autorisation de mise sur le marché en juin 2016 pour les indications énoncées ci-dessus[7].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Dubbelman AC, Rosing H, Darwish M, D'Andrea D, Bond M, Hellriegel E, Robertson P, Beijnen JH, Schellens JH, « Pharmacocinétique et excrétion de 14C-bendamustine chez les patients atteints d'une tumeur maligne récidivante ou réfractaire », Médicaments en R&D, vol. 13, no 1, , p. 17–28 (PMID 23322528, PMCID 3627029, DOI 10.1007/s40268-012-0001-5)
- Haute Autorité de Santé, « LEVACT (bendamustine), agent alkylant », sur https://www.has-sante.fr
- Ozegowski W, Krebs D, « Aminosäureantagonisten. III. ω‐[Bis‐(β‐chloräthyl)‐amino‐benzimidazolyl‐(2)]‐propion‐ bzw. ‐buttersäuren als potentielle Cytostatika », Advanced Synthesis and Catalysis, vol. 20, nos 3–4, , p. 178–186 (DOI 10.1002/prac.19630200310)
- « Cephalon press release – Cephalon Receives FDA Approval for TREANDA, a Novel Chemotherapy for Chronic Lymphocytic Leukemia »
- « Cephalon press release -Cephalon Receives FDA Approval for TREANDA to Treat Patients with Relapsed Indolent Non-Hodgkin's Lymphoma »
- Haute Autorité de Santé, « Avis de la Commission de Transparence de la HAS : bendamustine », sur https://www.has-sante.fr,