Auto-inducteur 2
L'auto-inducteur 2, ou AI-2, est une molécule de signalisation cellulaire intervenant dans la détection du quorum[2]. C'est l'une des très rares biomolécules contenant du bore. L'AI-2 a été identifié pour la première fois chez la bactérie marine Vibrio harveyi (en) et est produite et reconnue par de nombreuses bactéries à Gram négatif et à Gram positif[3] - [4]. Il se forme par réaction d'acide borique avec du 1-désoxy-3-déshydro-D-ribulose, dérivant lui-même de la 4,5-dihydroxy-2,3-pentanedione (en), dérivant lui-même de la S-adénosylhomocystéine sous l'action d'une S-ribosylhomocystéine lyase (en)[5].
| Auto-inducteur 2 | |
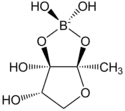
| |
| Structure de l'auto-inducteur 2 | |
| Identification | |
|---|---|
| Nom UICPA | dihydroxy[(2S,3R,4S)-2-méthyldihydrofuran-2,3,3,4(2H)-tétrolato(2-)-κ2O2,O3]borate(1−) |
| Synonymes |
AI-2 |
| PubChem | 446576 |
| ChEBI | 40646 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H10BO7 |
| Masse molaire[1] | 192,94 ± 0,014 g/mol C 31,13 %, H 5,22 %, B 5,6 %, O 58,05 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
AI-2 est absorbé par transport actif sur un transporteur ABC chez les Enterobacteriaceae et quelques autres taxons bactériens (Pasteurella, Photorhabdus, Haemophilus, Bacillus)[6] puis est phosphorylé à l'intérieur des cellules par une auto-inducteur 2 kinase notée lsrK. Le phospho-AI-2 se lie ensuite à un répresseur de transcription, la protéine lsrR, qui s'en trouve libéré du promoteur/opérateur de l'opéron lsr, permettant la transcription des gènes de cet opéron. La signalisation par l'auto-inducteur 2 est également régulée par le glucose et l'AMPc/CRP à travers l'opéron lsr. En présence de glucose, un faible taux d'AMPc/CRP conduit à pratiquement aucune expression de l'opéron lsr (protéines lsrABCDFG). En l'absence de glucose, AMPc-CRP est nécessaire pour stimuler l'expression de lsr tandis que la protéine lsrR réprime cette expression en l'absence de phospho-AI-2. L'accumulation de ce dernier permet l'absorption d'un surcroît d'AI-2 par le complexe lsrABCD, AI-2 qui est ensuite posphorylé par lsrK et peut enfin lever la répression de l'opéron lsr, ce qui accroît encore davantage l'absorption d'AI-2[7].
Le fait que l'AI-2 soit un signal universel est discuté. Bien que le gène luxS de la S-ribosylhomocystéine lyase (en), enzyme clé de la formation d'AI-2, soit un gène largement répandu, l'AI-2 est avant tout un sous-produit du recyclage de la S-adénosyl-L-méthionine[8]. L'utilisation certaine de l'AI-2 comme molécule de signalisation est en réalité limitée aux microorganismes dont on connaît des gènes de récepteurs d'AI-2[9]. Par conséquent, bien que certaines bactéries répondent à l'auto-inducteur 2, il n'est pas certain que cette molécule soit toujours produite à des fins de signalisation.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) J. G. Cao et E. A. Meighen, « Purification and structural identification of an autoinducer for the luminescence system of Vibrio harveyi », The Journal of Biological Chemistry, vol. 264, no 36, , p. 21670-21676 (PMID 2600086, lire en ligne)
- (en) Stephen T. Miller, Karina B. Xavier, Shawn R. Campagna, Michiko E. Taga, Martin F. Semmelhack, Bonnie L. Bassler et Frederick M. Hughson, « Salmonella typhimurium Recognizes a Chemically Distinct Form of the Bacterial Quorum-Sensing Signal AI-2 », Molecular Cell, vol. 15, no 5, , p. 677-687 (PMID 15350213, DOI 10.1016/j.molcel.2004.07.020, lire en ligne)
- (en) Melissa B. Miller et Bonnie L. Bassler, « Quorum Sensing in Bacteria », Annual Review of Microbiology, vol. 55, , p. 165-199 (PMID 11544353, DOI 10.1146/annurev.micro.55.1.165, lire en ligne)
- (en) Jinge Zhu, Eric Dizin, Xubo Hu, Anne-Sophie Wavreille, Junguk Park et Dehua Pei, « S-Ribosylhomocysteinase (LuxS) Is a Mononuclear Iron Protein », Biochemistry, vol. 42, no 16, , p. 4717-4726 (PMID 12705835, DOI 10.1021/bi034289j, lire en ligne)
- (en) Fabio Rezzonico, Theo H. M. Smits et Brion Duffy, « Detection of AI-2 Receptors in Genomes of Enterobacteriaceae Suggests a Role of Type-2 Quorum Sensing in Closed Ecosystems », Sensors, vol. 12, no 5, , p. 6645-6665 (PMID 22778662, PMCID 3386761, DOI 10.3390/s120506645, lire en ligne)
- (en) Liang Wang, Yoshifumi Hashimoto, Chen-Yu Tsao, James J. Valdes et William E. Bentley, « Cyclic AMP (cAMP) and cAMP Receptor Protein Influence both Synthesis and Uptake of Extracellular Autoinducer 2 in Escherichia coli », Journal of Bacteriology, vol. 187, no 6, , p. 2066-2076 (PMID 15743955, PMCID 1064054, DOI 10.1128/JB.187.6.2066-2076.2005, lire en ligne)
- (en) Stephen P. Diggle, Andy Gardner, Stuart A. West et Ashleigh S. Griffin, « Evolutionary theory of bacterial quorum sensing: when is a signal not a signal? », Philosophical Transactions of the Royal Society B, vol. 362, no 1483, , p. 1241-1249 (PMID 17360270, PMCID 2435587, DOI 10.1098/rstb.2007.2049, lire en ligne)
- (en) Fabio Rezzonico et Brion Duffy, « Lack of genomic evidence of AI-2 receptors suggests a non-quorum sensing role for luxS in most bacteria », BMC Microbiology, vol. 8, , p. 154 (PMID 18803868, PMCID 2561040, DOI 10.1186/1471-2180-8-154, lire en ligne)