Acide orthosilicique
L'acide orthosilicique est un composé chimique de formule Si(OH)4. Synthétisé à l'aide de solvants organiques[2], cette espèce d'acide silicique existe à concentration millimolaire dans les solutions aqueuses de dioxyde de silicium SiO2, qui est formellement son anhydride :
| Acide orthosilicique | |
| |
| __ H __ O __ Si Structure de l'acide orthosilicique |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.030.421 |
| No CE | 233-477-0 |
| PubChem | 14942 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H4SiO4 |
| Masse molaire[1] | 96,114 9 ± 0,001 8 g/mol H 4,19 %, O 66,58 %, Si 29,22 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Des simulations numériques indiquent que la dissolution de la silice dans l'eau passe par la formation d'un complexe SiO2·2H2O avant de former l'acide orthosilicique[3]. Une expérience publiée en 1922 indique avoir obtenu une solution aqueuse contenant environ 1 % d'acide orthosilicique en traitant une solution d'orthosilicate de sodium Na4SiO4 diluée avec un excès d'acide chlorhydrique HCl dilué puis en éliminant par dialyse le chlorure de sodium NaCl formé, et en purifiant le produit final à travers un filtre à eau en céramique (en)[4]. L'expérience montra que les solutions d'acide orthosilicique à ce niveau de concentration sont instables et tendent à former du gel de silice par formation d'acides siliciques et d'anions silicate polymériques.
La solubilité du dioxyde de silicium dans l'eau dépend fortement de sa structure cristalline. La solubilité de la silice amorphe de 0 à 250 °C à la pression de vapeur de solutions aqueuses est donnée par l'égalité :
- log C = -731/T + 4,52
où C est la concentration massique de silice en milligrammes par kilogramme et T la température en kelvins[5]. Cela correspond à une solubilité maximum d'environ 2 mmol·L-1 à température ambiante, concentration au-delà de laquelle on obtient du gel de silice[4]. Les espèces chimiques correspondant à l'acide orthosilicique en solution aqueuse n'ont pas été pleinement caractérisées en raison de leur très faible concentration. Linus Pauling avait prédit que l'acide orthosilicique serait un acide très faible[6] :
Le monomère d'acide orthosilicique a cependant été obtenu par hydrogénolyse de tétrakis(benzoyloxy)silane Si(OCH2C6H5)4 en solution dans le diméthylacétamide CH3CON(CH3)2 ou des solvants apparentés[2]. La structure cristalline du composé a été déterminée par cristallographie aux rayons X, tandis que la diffraction de neutrons a permis de localiser les atomes d'hydrogène dans la structure. L'acide pyrosilicique H6SiO7 a été obtenu par hydrogénation de son dérivé hexabenzoyloxy R3Si–O–SiR3 où R = CH3C6H4O, tandis que l'acide trisilicique cyclique Si3O3(OH)6 et l'acide tétrasilicique cyclique Si4O4(OH)8 ont été obtenus par des variantes de cette méthode[2].
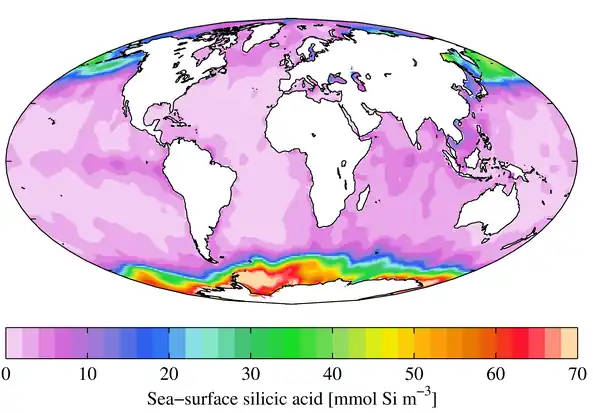 Concentration superficielle annuelle moyenne en silice dissoute[7].
Concentration superficielle annuelle moyenne en silice dissoute[7].
Le terme de silice dissoute est utilisé en océanographie pour décrire les formes hydrosolubles du dioxyde de silicium, notamment l'acide orthosilicique H4SiO4 et ses bases conjuguées (anions orthosilicate) tels que H3SiO4− et H2SiO42−. Le cycle biogéochimique de la silice est régulé par les diatomées[8] - [9]. Ces algues polymérisent l'acide silicique en silice biogénique (en) pour construire leur paroi cellulaire, appelée frustule[10].
La surface de l'océan mondial est sous-saturée en silice dissoute hormis dans le courant circumpolaire antarctique au sud du 55e parallèle sud. La concentration de silice dissoute augmente avec la profondeur et dans la circulation thermohaline depuis l'océan Atlantique à travers l'océan Indien jusqu'à l'océan Pacifique.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Masayasu Igarashi, Tomohiro Matsumoto, Fujio Yagihashi, Hiroshi Yamashita, Takashi Ohhara, Takayasu Hanashima, Akiko Nakao, Taketo Moyoshi, Kazuhiko Sato et Shigeru Shimada, « Non-aqueous selective synthesis of orthosilicic acid and its oligomers », Nature Communications, vol. 8, , article no 140 (PMID 28747652, PMCID 5529440, DOI 10.1038/s41467-017-00168-5, Bibcode 2017NatCo...8..140I, lire en ligne)
- (en) Bhaskar Mondal, Deepanwita Ghosh et Abhijit K. Das, « Thermochemistry for silicic acid formation reaction: Prediction of new reaction pathway », Chemical Physics Letters, vol. 478, nos 4-6, , p. 115-119 (DOI 10.1016/j.cplett.2009.07.063, Bibcode 2009CPL...478..115M, lire en ligne)
- (en) W. E. Gye et W. J. Purdy, « The Poisonous Properties of Colloidal Silica. I: The Effects of the Parenteral Administration of Large Doses », The British Journal of Experimental Pathology, vol. 3, no 2, , p. 75-85 (PMCID 2047780, lire en ligne)
- (en) Robert O. Fournier et Jack R. Rowe, « The solubility of amorphous silica in water at high temperatures and high pressures », American Mineralogist, vol. 62, nos 9-10, , p. 1052-1056 (lire en ligne)
- (en) Linus Pauling, The nature of the chemical bond, 3e éd., Ithaka, Cornell University Press, 1960, p. 557. (ISBN 978-0801403330)
- (en) « World Ocean Atlas 2009 », sur https://www.nodc.noaa.gov/, World Ocean Atlas, (consulté le ).
- (en) R. Siever, « Silica in the oceans: biological-geological interplay », S. H. Schneider et P. H. Boston, Scientists On Gaia, The MIT Press, 1991, p. 287-295.
- (en) Paul Tréguer, David M. Nelson, Aleido J. Van Bennekom, David J. DeMaster, Aude Leynaert et Bernard Quéguiner, « The Silica Balance in the World Ocean: A Reestimate », Science, vol. 268, no 5209, , p. 375-379 (PMID 17746543, DOI 10.1126/science.268.5209.375, JSTOR 2886587, Bibcode 1995Sci...268..375T, lire en ligne)
- (en) Yolanda Del Amo et Mark A. Brzezinski, « The chemical form of dissolved Si taken up by marine diatoms », Journal of Phycology, vol. 35, no 6, , p. 1162-1170 (DOI 10.1046/j.1529-8817.1999.3561162.x, lire en ligne)
Voir aussi
Articles connexes
Bibliographie
- Lancelot C (2007) Transformations biogéochimiques et transfert du silicium dans la zone de transition fleuve-mer: le rôle des diatomées planctoniques (Doctoral dissertation, Université Libre de Bruxelles).
