Acétylure
L'acétylure ou acétylénure ou éthynure ou encore dicarbure est un anion divalent de formule C22− ou (C≡C)2−. C'est la base conjuguée de l'éthyne, C2H2 ou H-C≡C-H, le prototype des alcynes qui se comporte comme un acide faible, c'est-à-dire qui peut perdre ses deux protons.
Ce terme est aussi utilisé pour tout anion monovalent de la forme R-C≡C−, où R peut être tout substituant organique monovalent comme hydrogénoacétylure, H-C≡C− ou méthylacétylure, H3C-C≡C−.
Ces noms d'anion sont aussi utilisés pour tout sel qui les contient comme l'acétylure de cuivre(I), (Cu+)2·C22−, hydrogénoacétylure de lithium, Li+·HC2− ou le méthylacétylure d'argent, Ag+·(CH3)C2−. Certains sels de l'anion C22− sont traditionnellement appelés carbures, par exemple le carbure de calcium, Ca2+·C22− et le carbure de lithium, (Li+)2·C22−.
Certains acétylures sont explosifs et leur formation accidentelle est un risque majeur de sécurité dans le traitement de l'acétylène et de son stockage. Les acétylures sont des réactifs très utiles en chimie organique.
Synthèse
Les acétylures des métaux alcalins peuvent être préparés en dissolvant le métal dans l'ammoniac liquide et en faisant buller de l'acétylène dans la solution.
L'acétylure de cuivre(I) peut être préparé en faisant buller de l'acétylène dans une solution aqueuse de chlorure de cuivre I. L'acétylure d'argent peut être obtenu de la même façon à partir de nitrate d'argent.
Le carbure de calcium est préparé par réaction de carbone avec de la chaux, CaO à approximativement 2 000 °C. Un procédé similaire est utilisé pour produire le carbure de lithium.
Réactions
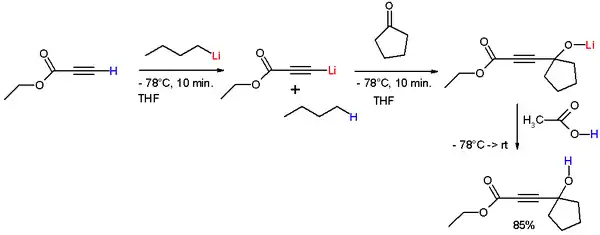
Les ions acétylure sont très utiles en synthèse organique pour l'adjonction de chaînes carbonées, en particulier dans des réactions d'addition et de substitution. Un type de réaction effectuée par les acétylures est l'addition sur les cétones qui forme des alcools tertiaires. Dans la réaction représentée schéma 1, le proton alcynique du propynoate d'éthyle est éliminé par le n-butyllithium à −78 °C pour former le 1-lithio-propynoate d'éthyle qui, additionné à la cyclopentanone, forme un alkoxyde de lithium. De l'acide acétique est ajouté pour supprimer le lithium et libérer l'alcool libre[1]
Les réactions de couplage d'alcynes comme le couplage de Sonogashira, le couplage de Cadiot-Chodkiewicz, le couplage de Glaser et la réaction d'Eglinton ont très souvent des acétylures métalliques comme intermédiaires.
Plusieurs modifications de la réaction avec les carbonyles sont connues:
- Dans la synthèse de Arens-van Dorp, l'éthoxyéthyne, CH3CH2-O-C≡CH[2] est converti en réactif de Grignard pour réagir avec une cétone. Le produit de la réaction est un alcool propargylique[3].
- Dans la modification d'Isler, l'éthoxyéthyne est remplacé par le β-chlorovinyl éther et la base est l'amidure de sodium.
- Dans la synthèse de Favorskii-Babayan, des cétones et des composés acétyléniques réagissent en présence d'alcali[4].
La formation des acétylures pose un risque dans la gestion de l'acétylène gazeux en présence de métaux tels que le mercure, l'argent ou le cuivre et aussi de leurs alliages à teneur élevée (laiton, bronze, alliage de soudure à l'argent).
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Acetylide » (voir la liste des auteurs).
- M. Mark Midland, Alfonso Tramontano, John R. Cable, Synthesis of alkyl 4-hydroxy-2-alkynoates, J. Org. Chem., 1980, vol. 45(1),pp. 28-29. Résumé.
- E. R. H. Jones, Geoffrey Eglinton, M. C. Whiting, and B. L. Shaw, Etoxyacethylene, Org. Synth., coll. « vol. 4 », , p. 404
- van Dorp and Arens, Nature, 1947, vol. 160, p. 189.
- (en) Synthèse de Favorskii-Babayan