Vanadocène
Le vanadocène ou bis(η5-cyclopentadiényl)vanadium(II) est un composé organométallique de formule V(C5H5)2,souvent abrégée en Cp2V. Il fait partie de la famille des composés composés sandwich et plus précisément de la sous-famille des métallocènes. Il se présente sous la forme d'un solide cristallin violet paramagnétique. Il ne possède que peu d'usages pratiques, mais a fait l'objet de nombreuses études.
| Vanadocène | |
| |
| Identification | |
|---|---|
| Nom UICPA | vanadocène bis(η5-cyclopentadiényl)vanadium(II) |
| No CAS | |
| No ECHA | 100.149.756 |
| PubChem | 11984630 |
| Apparence | solide cristallin violet[1] |
| Propriétés chimiques | |
| Formule | C10H10V |
| Masse molaire[2] | 181,127 9 ± 0,008 8 g/mol C 66,31 %, H 5,56 %, V 28,12 %, |
| Propriétés physiques | |
| T° fusion | 165 à 167 °C[1] |
| T° ébullition | 200 °C (sublimation, 1 mmHg)[3] |
| Solubilité | se décompose dans l'eau[4] |
| Précautions | |
| SGH[1] | |
  |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Structure et propriétés
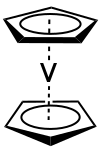
Le vanadocène a la structure typique des métallocènes, c'est-à-dire qu'il est constitué d'un atome central métallique l'état d'oxydation +II (Va2+) pris en sandwich entre deux cycles de cyclopentadiényle (Cp) auquel il est lié par des liaisons haptiques Va-C d'une longueur moyenne de 226 pm[5]. Ce centre de vanadium(II) est équidistant des centroïdes de cycles Cp, localisé à un centre cristallographique d'inversion. À l'état solide. la molécule a une symétrie D5d. Au-dessus de −103,15 °C, les cycles Cp du vanadocène sont perturbées dynamiquement et ne sont que parfaitement ordonnées en dessous de −165,15 °C.
L'énergie de dissociation des liaisons Cp–V est d'après la littérature comprise entre 145 kJ mol−1 et 369 kJ mol−1[6] - [7].
Le vanadocène est un analogue du ferrocène mais n'en est pas un isoélectronique ; il ne respecte ainsi pas la règle des 18 électrons avec seulement 15 électrons de valence.
Synthèse
Le vanadocène fut synthétisé la première fois par Birmingham, Fischer et Wilkinson par réduction du dichlorure de vanadocène par l'hydrure d'aluminium, puis le vanadocène est sublimé dans le vide à 100 °C[8].
En 1977, Köhler et al. sont parvenus à synthétiser le vanadocène par réaction entre le complexe de vanadium [V2Cl3(THF)6]2[Zn2Cl6] avec le cyclopentadiénure de sodium[9] - [10] :
Cette méthode est toujours employée aujourd'hui et permet de produire de grandes quantités de vanadocène.
Le chlorure de vanadium(III) peut également être directement mis à réagir avec le cyclopentadiénure de sodium, mais il réagit alors également comme réducteur formant le sous-produit de couple de deux cycles Cp, le dihydrofulvalène[11] :
- 2 VCl3 + 6 Na(C5H5) → 2 V(C5H5)2 + 6 NaCl + H5C5-C5H5
Réactivité
Le vanadocène est une molécule réactive. Il peut être facilement oxydé en monocation par réaction avec un sel de ferrocénium dans le toluène[12] :
- V(C5H5)2 + [Fe(C5H5)2][BR4] ⟶ [V(C5H5)2][BR4] + Fe(C5H5)2
où R est un groupe phényle ou le groupe 4-fluorophényle. Ces monocations sont extrêmement sensibles à l'air et ont un potentiel rédox de -1,10 V[12].
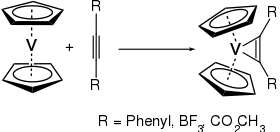
Du fait de ces 15 électrons de valence, le vanadocène réagit facilement avec d'autres ligands. Il peut par exemple réagir avec des dérivés acétyléniques, pour donner le complexe de cyclopropènevanadium correspondant :
Par échange de cycle réductif avec le n-butyllithium en présence de cyclohexa-1,3-diène, un de ses cycles de cyclopentadiène peut être remplacé par un cycle benzène[13] :
- V(C5H5)2 ⟶ V(C5H5)(C6H6).
Il réagit aussi avec le monoxyde de carbone, pour former un dérivé ionique du vanadocène, lorsque la réaction se fait en atmosphère inerte :
- Cp2V + V(CO)6 → [Cp2V(CO)2][V(CO)6]
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Vanadocene » (voir la liste des auteurs) et en allemand « Vanadocen » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé Bis(cyclopentadienyl)vanadium(II), consultée le 20 novembre 2014.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Alfa Aesar, consultée le 20 novembre 2014
- L. Poirier, F Teyssandier, « Thermodynamics approach of the OMCVD of vanadum carbide form vanadocene », Electrochemical Society Proceding, vol. 96-5, , p. 757 (ISBN 978-1566771559)
- Robin D. Rogers, Jerry L. Atwood, Don Foust, and Marvin D. Rausch, « Crystal Structure of Vanadocene », Journal of Crystal and Molecular Structure, vol. 11, nos 5–6, , p. 183–188 (DOI 10.1007/BF01210393)
- Arnold F. Holleman, Egon Wiberg, Nils Wiberg, Lehrbuch der anorganischen Chemie, de Gruyter Verlag, , 1699–1703 p. (ISBN 3-11-012641-9)
- James E. Huheey, Ellen A. Keiter, Richard Keiter, Anorganische Chemie : Prinzipien von Struktur und Reaktivität, de Gruyter Verlag, , 1261 p. (ISBN 3-11-017903-2), p. 797
- Birmingham, J. M., A. K. Fischer, and G. Wilkinson, « The Reduction of Bis-cyclopentadienyl Compounds », Naturwissenschaften, vol. 42, no 4, , p. 96 (DOI 10.1007/BF00617242)
- (en) C. Lorber: "Vanadium Organometallics." Chapter 5.01. Comprehensive Organometallic Chemistry III. Elsevier, 2007. 1-60.
- (de) « Dissertation de Markus Jordan, Carl von Ossietzky Universität Oldenburg, 2009 »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (PDF, 5,4 MB).
- (de) Integriertes Synthesepraktikum (ISP) Uni Hamburg: Vanadocen, (PDF, 58 kB).
- Calderazzo, Fausto, Isabella Ferri, Guido Pampaloni, and Ulli Englert, « Oxidation Products of Vanadocene and of Its Permethylated Analogue, Including the Isolation and the Reactivity of the Unsolvated [VCp]Cation », Organometallics, vol. 18, no 13, , p. 2452–2458 (DOI 10.1021/om9809320)
- Dissertation von Thomas Kupfer, Universität Würzburg, 2007 (PDF, 10,6 MB).
