Thioacétone
La thioacétone est un composé organosulfuré de formule chimique (CH3)2C=S. Il s'agit d'un liquide brun orangé instable qui ne peut être isolé qu'à basse température[4]. Sa couleur se teinte de rouge en fonction de sa concentration en tautomère[5] CH2=C(SH)−CH3. À une température supérieure à −20 °C, elle donne facilement un trimère, la trithioacétone (en)[6] [(CH3)2CS]3, plus stable et donc plus abondante que les autres polymères susceptibles de se former également[4] - [7]. La thioacétone n'est pas soluble dans l'eau, mais est soluble dans l'éther diéthylique, le benzène et l'éthanol. Elle est caractérisée par une odeur particulièrement puissante et pestilentielle[8], et est considérée comme l'une des substances les plus malodorantes connues, au point d'en rendre l'étude malaisée[9].
| Thioacétone | |
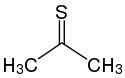
| |
| Structure de la thioacétone. | |
| Identification | |
|---|---|
| Nom UICPA | propane-2-thione |
| No CAS | |
| PubChem | 641811 |
| ChEBI | 36580 |
| SMILES | |
| InChI | |
| Apparence | liquide brun orangé[1] |
| Propriétés chimiques | |
| Formule | C3H6S |
| Masse molaire[2] | 74,145 ± 0,008 g/mol C 48,6 %, H 8,16 %, S 43,25 %, |
| Propriétés physiques | |
| T° fusion | −55 °C[3] −40 °C[1] |
| T° ébullition | 70 °C[3] 80 °C[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
On la produit généralement par thermolyse de la trithioacétone, elle-même obtenue par pyrolyse du sulfure allylique d'isopropyle (CH3)2CHSCH2CH=CH2 ou en traitant l'acétone (CH3)2C=O avec du sulfure d'hydrogène H2S en présence d'un acide de Lewis[10] - [11]. Le trimère (1) se décompose à une température de 500 à 600 °C pour donner la thiocétone[3] - [4] - [7] (2) :

Polymérisation
La thioacétone, au contraire de son analogue oxygéné l'acétone, polymérise spontanément même à très basse température, qu'elle soit pure ou dissoute dans l'éther diéthylique ou l'oxyde d'éthylène, en donnant un solide blanc qui est un mélange variable d'un polymère linéaire ···–[C(CH3)2–S–]n –··· et du trimère cyclique trithioacétone (en) [(CH3)2CS]3. L'absorption infrarouge de ce produit s'observe principalement à 2 950, 2 900, 1 440, 1 150, 1 360 et 1 375 cm−1 en raison des paires de méthyles géminés, et à 1 085 et 643 cm−1 en raison de la liaison C–S. Les spectres de RMN du proton montrent un seul pic pour un déplacement de 8,1[3].
La masse moléculaire moyenne du polymère varie de 2 à 14 kDa selon la méthode de préparation, la température et la présence du tautomère thioénol (en). Le polymère fond dans une plage d'environ 70 à 125 °C. La polymérisation est favorisée par les radicaux libres et la lumière[3].
Le trimère cyclique trithioacétone est un composé blanc ou incolore ayant un point de fusion de 24 °C, proche de la température ambiante. Il a également une odeur désagréable[6].
Odeur
L'odeur particulièrement incommodante et tenace de la thioacétone a été notée dès la première synthèse de ce composé à la fin du 19e siècle par deux chimistes allemands à Fribourg-en-Brisgau. Ils expliquent que « l'odeur s'est propagée en peu de temps à des distances de 3 à 4 kilomètres jusqu'aux parties reculées de la ville. Les habitants des rues adjacentes au laboratoire se sont plaints que la substance odorante avait provoqué des évanouissements, des nausées et des vomissements chez certaines personnes », les chimistes précisant : « Selon notre expérience, l'intensité de l'odeur de ce produit surpasse tout ce qu'on connaît en matière de substances très odorantes »[12].
Toujours au 19e siècle, une expérience aux Whitehall Soap Works à Leeds sur la manière de rendre odorant le gaz à l'eau pour prévenir les intoxications avait conduit à étudier la thioacétone, ce qui s'était soldé par des difficultés avec le voisinage, l'odeur décrite comme « épouvantable » ayant incommodé les ouvriers au point de les contraindre à cesser le travail, tandis que la puanteur empirait à mesure que le composé se diluait dans l'air[13].
L'expérience a été renouvelée à la fin des années 1960 par deux chimistes de l'ex Esso Research Centre (en) d'Abingdon, dans l'Oxfordshire, qui ont rapporté leurs difficultés à gérer l'ampleur de la situation olfactive provoquée par leurs essais[14].
Notes et références
- (en) O. G. von Ettinghausen et E. Kendrick, « Polythioacetone », Polymer, vol. 7, no 9, , p. 469-474 (DOI 10.1016/0032-3861(66)90005-X, lire en ligne).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) William H. Sharkey, « Polymerization through the carbon-sulfur double bond », Advances in Polymer Science, vol. 17, , p. 73-103 (DOI 10.1007/3-540-07111-3_2, lire en ligne).
- (en) V. C. E. Burnop et K. G. Latham, « Polythioacetone », Polymer, vol. 8, , p. 589-607 (DOI 10.1016/0032-3861(67)90069-9, lire en ligne).
- (en) Roland Mayer, J. Morgenstern et J. Fabian, « Aliphatic Thioketones », Angewandte Chemie International Edition, vol. 3, no 4, , p. 277-286 (DOI 10.1002/anie.196402771, lire en ligne).
- (en) R. D. Lipscomb et W. H. Sharkey, « Characterization and polymerization of thioacetone », Journal of Polymer Science Part A-1: Polymer Chemistry, vol. 8, no 8, , p. 2187-2196 (DOI 10.1002/pol.1970.150080826, lire en ligne).
- (en) H.W. Kroto, B.M. Landsberg, R.J. Suffolk et A. Vodden, « The photoelectron and microwave spectra of the unstable species thioacetaldehyde, CH3CHS, and thioacetone, (CH3)2CS », Chemical Physics Letters, vol. 29, no 2, , p. 265-269 (DOI 10.1016/0009-2614(74)85029-3, lire en ligne).
- (de) E. Fromm et E. Baumann, « Ueber Thioderivate der Ketone », Berichte der deutschen chemischen Gesellschaft, vol. 22, no 1, , p. 1035-1045 (DOI 10.1002/cber.188902201224, lire en ligne).
- (en) Derek Lowe, « Things I Won't Work With: Thioacetone », sur https://www.science.org/, Science, (consulté le ).
- (en) William J. Bailey et Hilda Chu, « Synthesis of polythioacetone », Polymer Preprints, vol. 6, , p. 145-155.
- (de) Horst Böhme, Hans Pfeifer et Erich Schneider, « Zur Kenntnis der dimeren Thioketone », Berichte der deutschen chemischen Gesellschaft (séries A et B), vol. 75, no 7, , p. 900-909 (DOI 10.1002/cber.19420750722, lire en ligne).
-
(en) E. Baumann et E. Fromm, « Ueber Thioderivate der Ketone », Berichte der deutschen chemischen Gesellschaft, vol. 22, no 2, , p. 2592-2599 (DOI 10.1002/cber.188902202151, lire en ligne) :
« verbreitete sich der Geruch in kurzer Zeit bis zu Entfernungen von 3/4 Kilometer bis in weit abgelegene Stadttheile. Bewohner der dem Laboratorium benachbarten Strassen beschwerten sich darüber, dass die riechende Substanz bei manchen Personen Ohnmachtsanfälle, Uebelkeit und Erbrechen bewirkt hätte. »
« Die Intensität des Geruches dieser Substanz übertrifft nach unseren Wahrnehmungen Alles, was in dieser Hinsicht von stark riechenden Stoffen bekannt geworden ist. »
-
(en) J. Lewkowitsch, « Odorising Water-Gas », Chemical News and Journal of Industrial Science, vol. 61, no 1589, , p. 219 :
« Similarly, the fearful smell of the thioacetone is brought out when it is diluted with large quantities of air. I had for this a very serious — although at the time a very welcome — confirmation. While distilling the product of the reaction of sulphuretted hydrogen on about 20 grms. of acetone, two workmen, working at the opposite end of the steel works, entered the laboratory complaining of the fearful smell, and declaring that they had been vomiting, felt altogether sick and unable to continue their work.. »
-
(en) Derek Lowe, « Things I Won't Work With: Thioacetone », sur https://www.science.org/, Science, (consulté le ) :
« Recently we found ourselves with an odour problem beyond our worst expectations. During early experiments, a stopper jumped from a bottle of residues, and, although replaced at once, resulted in an immediate complaint of nausea and sickness from colleagues working in a building two hundred yards away. (...) The odours defied the expected effects of dilution since workers in the laboratory did not find the odours intolerable. (...) To convince them otherwise, they were dispersed with other observers around the laboratory, at distances up to a quarter of a mile, and one drop of either acetone gem-dithiol or the mother liquors from crude trithioacetone crystallisations were placed on a watch glass in a fume cupboard. The odour was detected downwind in seconds. »