tert-Butylate de sodium
Le tert-butylate de sodium ou tert-butanolate de sodium, souvent abrégé t-BuONa, est un composé chimique de formule NaOC(CH3)3.
| tert-Butylate de sodium | |
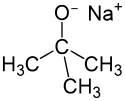
| |
| Structure du tert-butylate de sodium | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.011.584 |
| No CE | 212-741-9 |
| PubChem | 23676156 |
| SMILES | |
| InChI | |
| Apparence | poudre inodore inflammable blanche ou brunâtre[1] |
| Propriétés chimiques | |
| Formule | NaOC(CH3)3 |
| Masse molaire[2] | 96,103 4 ± 0,004 1 g/mol C 49,99 %, H 9,44 %, Na 23,92 %, O 16,65 %, |
| Propriétés physiques | |
| T° fusion | 180 °C[1] |
| Solubilité | se décompose violemment au contact de l'eau |
| Masse volumique | 1,025 g/cm3[1] à 20 °C |
| Point d’éclair | 14 °C[1] |
| Précautions | |
| SGH[1] | |
  Danger |
|
| NFPA 704[3] | |
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Utilisation
Il se présente sous la forme d'un solide inflammable sensible à l'humidité. Il est utilisé en chimie organique, comme base forte et comme base non nucléophile.
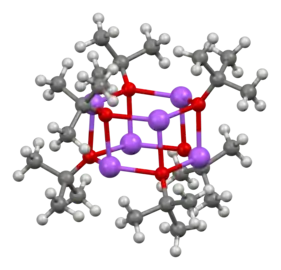
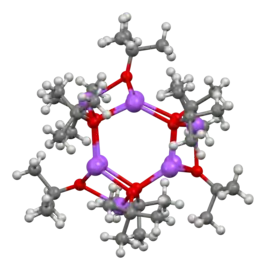
Sa réactivité est semblable à celle du tert-butylate de potassium KOC(CH3)3, plus commun. À l'état solide, il forme des clusters formés d'hexamères et de nonamères :
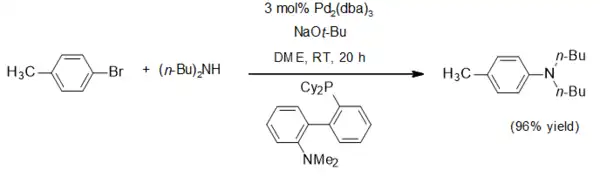
Le tert-butylate de sodium est utilisée par exemple dans la réaction de Buchwald-Hartwig[4] :
Le tert-butylate de sodium est utilisé pour préparer des complexes de tert-butylate. Par exemple, l'hexa(tert-butoxy)ditungstène(III) est obtenu par métathèse de l'heptachlorure de ditungstène dans le tétrahydrofurane (THF) :
Obtention
Ce composé peut être obtenu en traitant de l'alcool tert-butylique (CH3)3COH avec de l'hydrure de sodium NaH[5].
Notes et références
- Entrée « Sodium 2-methylpropan-2-olate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 6 avril 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Sodium tert-butoxide, 97% », sur Alfa Aesar (consulté le ).
- (en) Bryant H. Yang et Stephen L. Buchwald, « Palladium-catalyzed amination of aryl halides and sulfonates », Journal of Organometallic Chemistry, vol. 576, nos 1-2, , p. 125-146 (DOI 10.1016/S0022-328X(98)01054-7, lire en ligne)
- (en) P.-M. Dewick, Essentials of Organic Chemistry: For Students of Pharmacy, Medicinal Chemistry and Biological Chemistry, John Wiley & Sons, 2013, p. 157. (ISBN 978-1-118-68196-1)