Ribonucléase T1
La ribonucléase T1 est une endonucléase fongique qui catalyse le clivage de l'ARN monocaténaire à la suite des résidus de guanosine, c'est-à-dire sur leur côté 3’. La variété la mieux connue de cette enzyme est celle issue d’Aspergillus oryzae, une moisissure. En raison de sa spécificité pour les résidus de guanosine, la RNase T1 est souvent utilisée pour digérer l'ARN dénaturé préalablement à son séquençage. Tout comme la barnase et la ribonucléase A, la ribonucléase T1 a été l'objet de très nombreuses recherches sur le repliement des protéines[2].
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
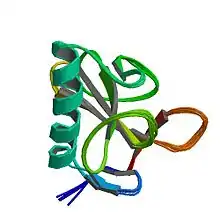
La RNase T1 est une petite protéine α+β de 104 résidus d'acides aminés ayant un feuillet β à quatre brins couvrant une longue hélice α (près de cinq tours). Elle possède deux ponts disulfure, entre les paires de résidus de cystéine Cys2-Cys10 et Cys6-Cys103, dont la seconde contribue davantage à la stabilité du repliement de la protéine[3]. La réduction complète des deux disulfures a généralement pour effet de déplier la protéine, bien que le repliement puisse être rétabli par une forte concentration saline[4].
Notes et références
- (en) Stefania Pfeiffer, Yasmin Karimi-Nejad et Heinz Rüterjans, « Limits of NMR structure determination using variable target function calculations: ribonuclease T1, a case study », Journal of Molecular Biology, vol. 266, no 2, , p. 400–423 (PMID 9047372, DOI 10.1006/jmbi.1996.0784, lire en ligne)
- (en) C. Nick Pace, Udo Heinemann, Ulrich Hahn et Wolfram Saenger, « Ribonuclease T1: Structure, Function, and Stability », Angewandte Chemie International Edition in English, vol. 30, no 4, , p. 343-360 (DOI 10.1002/anie.199103433, lire en ligne)
- (en) C. N. Pace, G. R. Grimsley, J. A. Thomson et B. J. Barnett, « Conformational stability and activity of ribonuclease T1 with zero, one, and two intact disulfide bonds », Journal of Biological Chemistry, vol. 263, no 24, , p. 11820-11825 (PMID 2457027, lire en ligne)
- (en) Motohisa Oobatake, Sho Takahashi et Tatsuo Ooi, « Conformational Stability of Ribonuclease T1. II. Salt-Induced Renaturation1 », Journal of Biochemistry, vol. 86, no 1, , p. 65-70 (PMID 113396, lire en ligne)