Paludine commune
Viviparus contectus

| Règne | Animalia |
|---|---|
| Embranchement | Mollusca |
| Classe | Gastropoda |
| Ordre | Pulmonata |
| Super-famille | Viviparoidea |
| Famille | Viviparidae |
| Sous-famille | Viviparinae |
| Genre | Viviparus |
- Paludina viviparus
La paludine commune (Viviparus contectus) est une espèce d'escargots d'eau douce de la famille des Viviparidae. Sa coquille, d'assez grande taille est épaisse et formée de 4 à 5 tours de spires chez l'adulte. La coquille est plus grande que celle de V. viviparus.

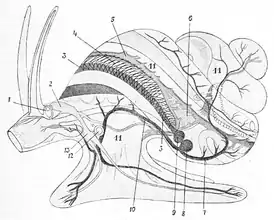


Ce mollusque vit dans les eaux fraiches à tempérées de l'Europe, plutôt lentes. Il serait plus commun que la Paludine vivipare.
À la différence des limnées et comme certains escargots marins, les Paludines peuvent se protéger de la déshydratation derrière un opercule étanche.
L'hybridation interspécifique (entre plusieurs espèces proches) a pu être obtenue[3], au moins en laboratoire, et elle produit des hybrides féconds dans certaines configurations de croisements.
Viviparité
Comme son nom latin l'indique, c'est un escargot vivipare ou ovovivipare, phénomène rare chez les escargots.
C'est le naturaliste Jan Swammerdam qui semble avoir été le premier à reconnaître le caractère vivipare des paludines[4]. Il a constaté que les œufs présents dans l'oviducte de la femelle de Viviparus viviparus contenait toutes un ou deux funicules, croyant même reconnaitre dans ces œufs un chorion et un amnios, mais il n'a pas découvert comment ils se formaient, ni comment ils parvenaient dans l'utérus et ne semble pas même avoir compris qu'il existait des mâles et des femelles chez cette espèce (la plupart des autres escargots sont hermaphrodites et on a longtemps cru à une génération spontanée ou à un autofécondation chez les escargots aquatiques).
C'est le naturaliste Émile Baudelot qui a ensuite clairement distingué les deux sexes chez les paludines et qui a compris qu'il n'existait pas d'hermaphroditisme chez ces espèces
- « L'appareil mâle s'étend depuis l’extrémité antérieure du tentacule droit jusqu'au sommet de la spire. On peut dans ce trajet lui considérer quatre portions bien distinctes, qui sont, en allant de haut en bas, le testicule, le canal déférent, le réservoir séminal et la verge. »[5].
Taxonomie
Cette espèce appartient au genre Viviparus qui appartient lui-même à la famille Viviparidae et à la sous-famille Viviparinae (dont la taxonomie est encore en cours d'étude et de développement [6]).
Elle était autrefois classée dans le genre Paludina (qui n'existe plus).
Elle est aussi classée dans le groupe informel des Architaenioglossa.
Synonymie
Selon l'INPN[7], cette espèce a aussi porté les noms (désuets) suivants
- [Missing]russiensis Milachewitsch, 1881 (CD_NOM = 412396)
- [Missing]vera Frauenfeld, 1862 (CD_NOM = 412398)
- Paludina contecta (CD_NOM = 61993)
- Paludina listeri Forbes & Hanley, 1850 (CD_NOM = 412395)
- Vivipara brachya Bourguignat, 1880 (CD_NOM = 412387)
- Vivipara carniolica Bourguignat, 1880 (CD_NOM = 412389)
- Vivipara communis Bourguignat, 1880 (CD_NOM = 412390)
- Vivipara corcyrensis Kobelt, 1908 (CD_NOM = 412391)
- Vivipara croatica Kobelt, 1908 (CD_NOM = 412392)
- Vivipara dalmatica Kobelt, 1908 (CD_NOM = 412388)
- Vivipara isseli Bourguignat, 1880 (CD_NOM = 412393)
- Vivipara kormosi Kobelt, 1909 (CD_NOM = 412394)
- Vivipara turrita Kobelt, 1909 (CD_NOM = 412397)
Description
La coquille des paludines communes est spiralée et globalement conique, de couleur beige (sens d'enroulement : dextre). Comme celle des autres paludines, elle est plus solide et épaisse que celle des autres escargots d'eau douce européens. Elle évoque celles des ampullaires (qui ne sont cependant pas apparentées aux Paludines).
L'animal peut s’y enfermer derrière un opercule rond orné de stries concentriques, qui lui permet de se protéger - durant plusieurs mois s'il le faut - de la déshydratation. L’opercule une fois fermé affleure l’ouverture de la coquille. Quand il est ouvert, cet opercule est fixé sur la partie dorsale et arrière du pied du mollusque, pied qui est assez large et dont la couleur varie du gris au verdâtre tachetée d'orange vif.
Sa bouche comporte une radula et un siphon respiratoire s'ouvre sur le côté droit de la tête, alimentant ses branchies situées en avant du cœur. Ce siphon lui permet aussi de filtrer l'eau
Il possède deux tentacules courts ; ses yeux sont sur le côté externe de chaque tentacule.
Dimorphisme sexuel
Le sexage des individus est aisé :
- Le mâle se distingue par un tentacule droit, plus court et au bout arrondi, qui fait aussi office de pénis lors de la fécondation ;
- La femelle est habituellement un peu plus grosse au même âge, et elle possède deux tentacules identiques.
Habitat et aire de distribution
La Paludine commune vit dans les eaux à faible courant de la zone dite paléarctique de l'Europe.
Alimentation
Cette espèce se nourrit de plancton, bactéries raclés sur le biofilm des substrats qu'elles explorent, et de plancton et microdébris en suspension dans l’eau (captés au moyen du siphon qui lui permet de respirer tout en filtrant l’eau).
Cette capacité de filtration la fait apprécier de propriétaires de bassins ou d'aquariums (elle peut toutefois y introduire certains parasites).
Reproduction
Comme son nom de genre scientifique le rappelle, la paludine est vivipare, et plus exactement ovovivipare.
La maturité sexuelle est atteinte au bout de deux ans, quand l’escargot mesure environ 2 cm de long. Chaque femelle porte des œufs (jusqu'à une trentaine et à tous les stades de développement) d’une taille de 3 à 7 mm de diamètre et jusqu’au développement complet de l’embryon. Au moment de leur expulsion, les jeunes mesurent environ 7 mm et leur coquille est déjà marquée des rayures caractéristiques des paludines. Après avoir produit tous ses jeunes, la femelle meurt.
Comportement
Ces escargots se montrent volontiers grégaires ; on les trouve souvent en groupes plus ou moins denses (pouvant atteindre des centaines d'individus) sur des branches immergées, des pieux ou divers objets artificiels présents sous l'eau. Plus rarement, ils sont présents de manière plus dispersée dans la vase et alors beaucoup plus discrets. On les trouve aussi dans certains étangs ou pièces d’eau artificielles, des réservoir de barrage et certains bras morts de cours d’eau encore plus ou moins liés à une rivière ou à un fleuve[8].
Les paludines passent facilement l’hiver sous la glace, mais à la différence d’autres mollusques aquatiques, elles meurent si elles gèlent.
État des populations, pressions, menaces
Statut de l’espèce : il est mal connu, faute d'informations. En 2014, ce taxon n'est pas protégé en France[9].
L’état et la dynamique des populations de cette espèce, et les éventuelles menaces qu’elles subit sont mal connus. L’espèce semble localement abondante, stable ou peut-être en augmentation, et pourrait être en régression ailleurs. La présence et reproduction de cette espèce nécessite certains critères de qualité de l'eau ; il se montre particulièrement sensible à la teneur de l'eau en oxygène dissous[10]
Plusieurs escargots aquatiques sont connus pour leur grande sensibilité à certains perturbateurs endocriniens, source d'imposex et en tant que racleur ou consommateurs de déchets, ils peuvent être intoxiqués par divers polluants toxiques présents dans l'eau et bioconcentrés par les algues ou bactéries, ou présents dans les sédiments (métaux lourds notamment, dont par exemple le plomb ou le cuivre [11].
Parasitoses
Les mollusques aquatiques d'eau douce sont presque toujours porteurs de parasites (une évaluation récente (en Allemagne en 2004) a trouvé 31 espèces de trématodes dans les escargots d'eau, appartenant à dix familles (avec 29 espèces de cercaire et sept espèces de métacercaires détectées chez 311 escargots appartenant à 15 espèces différentes ; 4,9 % du total des mollusques étudiés était porteur de l'un ou l'autre ou de ces deux types de parasites). Les Paludines et cette espèce en particulier ne font pas exception : elles jouent un rôle dans le cycle de ces parasites.
La Paludine commune est l’hôte intermédiaire de plusieurs espèces de trématodes[12] (ex : Echinostoma trivolvis[13]) qui finissent souvent leurs cycle chez les oiseaux[14] ou des animaux venant s’abreuver dans les cours d’eau.
Espèces proches
Des confusions sont possibles avec :
- Viviparus viviparus (Paludine d'Europe, ou Paludine vivipare), plus petite pour l'adulte que la Paludine commune
- Viviparus ater (Paludine des Alpes)
- Viviparus georgianus (I. Lea, 1834) ou Paludine géorgienne.
Hybridation
En 1997, des hybrides féconds ont être obtenus en laboratoire par croisement interspécifique de plusieurs espèces de Viviparus[3], mais à certaines conditions :
- Viviparus viviparus se croise avec V. ater, uniquement quand c'est le mâle V. viviparus qui féconde la femelle de V. ater ; la combinaison inverse est presque toujours stérile.
- De même il faut que ce soit le mâle de V. contectus qui féconde une femelle V. ater pour avoir une descendance[15].
Des indices génétiques laissent penser que des hybridations Viviparus ater X V. contectus existent aussi dans la nature[16].
Indices de présence
Dans les parties de cours d'eau où le courant ralentit ou tourbillonne, des dépôts de coquilles vides peuvent localement se former, qui sont de bons indices de présence de l'espèce localement ou légèrement en amont.
Utilisations
Plusieurs espèces du genre Viviparus sont élevées au Royaume-Uni et dans les pays germaniques pour des propriétaires de bassins et d’aquariums (d’eau froide) ; ils sont réputés y consommer les algues filamenteuses, certaines microalgues, cyanophycées et micro-déchets en suspension et ainsi contribuer à épurer et clarifier l’eau, mais peuvent être source d'introduction de certains parasites.
Cette espèce a été utilisée comme animal de laboratoire pour par exemple étudier :
- la base ionique de la conduction nerveuse des axones du système nerveux de mollusques[17] ; on y a trouvé deux types d'axones, les uns à vitesse de connexion lente (moyx : 0,02 m/s (à 23 °C) et les autres où l'influx nerveux circule plus vite (0,10 m/s (à 23 °C).
- la cinétique et répartition dans l'organisme d'un escargot du ruthénium 106 soluble (sous forme de complexes de nitrate de nitrosyle quand il est absorbé par l'animal après un à dix jours d'exposition[18], de manière à comparer cette cinétique à celle qui existe chez d'autres(Anadonta anatina (une sorte de moule d'eau douce) et deux escargots d'eau douce Lymnaea stagnalis et Viviparus contectus ou encore un poisson (Alburnus lucidus) et des organismes marins : Fucus vesiculosus (une algue de la famille des fucacée), Mytilus edulis (la moule commune), Littorina littorea et Purpura lapillus (deux gastéropodes marins souvent utilisés comme bioindicateurs).
- l'étude des fonctions biochimiques des caroténoïdes chez les mollusques (chez cette espèce ainsi que chez 7 autres mollusques d'eau douce et marine[19]) ; Selon cette étude, la fonction la plus probable des caroténoïdes chez les mollusques semble être la stabilisation de la fluidité des membranes cellulaires.
Notes et références
- Millet, P. A. 1813: Mollusques terrestres et fluviatiles, observés dans le Département de Maine et Loire. - pp. j.xj [= 1-11], 1-82, 1 tableau. Angers. (Pavie), page 5.
- Linnaeus C (1758) Systema Naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. 10th edition. - Vermes. Testacea: 700-781. Holmiae. (Salvius).
- Ribi G & Porter AH (1995) Mating between two hybridizing species, Viviparus aterandV. contectus (Mollusca: Prosobranchia). Animal Behaviour, 49(5), 1389-1398.
- Émile Baudelot (1863) Recherches sur l'appareil générateur des mollusques gastéropodes (en Livre numérique Google) Imprimerie de L. Martinet, (voir page 6 et 79 sur 117).
- Baudelot E (1863) Recherches sur l'appareil générateur des Mollusques Gastéropodes (Thèse de zoologie), Imprimerie de L. Martinet.
- ipp.boku.ac.at
- Source INPN ; synonymie de noms latins pour la Paludine commune
- Jakubik B (2012) Life strategies of Viviparidae (Gastropoda: Caenogastropoda: Architaenioglossa) in various aquatic habitats: Viviparus viviparus (Linnaeus, 1758) and V. contectus (Millet, 1813). Folia Malacologica, 20(3), 145-179 (« Résumé »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?))
- INPN Statut de la Paludine d’Europe, consulté 2014-03-20.
- Eleutheriadis N & Lazaridou-Dimitriadou M (1995) Density and growth of freshwater prosobranch snails (Bithynia graeca and Viviparus contectus) in relation to water chemistry in Serres, Northern Greece. Journal of molluscan studies, 61(3), 347-352 (résumé).
- Svendsen, C., & Weeks, J. M. (1995). The use of a lysosome assay for the rapid assessment of cellular stress from copper to the freshwater snail Viviparus contectus(Millet). Marine pollution bulletin, 31(1), 139-142 (résumé).
- Faltýnková A & Haas W (2006) Larval trematodes in freshwater molluscs from the Elbe to Danube rivers (Southeast Germany): before and today. Parasitology Research, 99(5), 572-582 (résumé et extrait)
- Kanev I, Fried B, Dimitrov V & Radev V (1995) Redescription of Echinostoma trivolvis (Cort, 1914)(Trematoda: Echinostomatidae) with a discussion on its identity. Systematic Parasitology, 32(1), 61-70
- Brown FJ (1926) Some British freshwater larval trematodes with contributions to their life histories. Parasitology, 18(01), 21-34
- Trüb H & Ribi G (1997) High fecundity of hybrids between the sympatric snail species Viviparus ater and V. contectus (Gastropoda: Prosobranchia). Heredity, 79(4) (résumé)
- Katoh M & Ribi G (1996) Genetic evidence for natural hybridization and apparent introgression between freshwater snail species (Viviparus ater and V. contectus). Journal of Evolutionary Biology, 9(1), 67-82.
- Sattelle DB (1972) The ionic basis of axonal conduction in the central nervous system of Viviparus contectus (Millet)(Gastropoda: Prosobranchia). Journal of Experimental Biology, 57(1), 41-53 (résumé)
- Van der Borght O & Van Puymbroeck S (1970) Initial Uptake, Distribution and Loss of Soluble 106Ru in Marine and Freshwater Organisms in Laboratory Conditions. Health physics, 19(6), 801-811 (résumé).
- Vershinin A (1996) Carotenoids in Mollusca: approaching the functions Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 113(1), 63-71
Voir aussi
Articles connexes
- Caenogastropoda
- Paludine d'Europe (= Paludine vivipare)
Liens externes
- (en) Référence UICN : espèce Viviparus contectus (consulté le )
- (en) Référence NCBI : Viviparus contectus (taxons inclus)
- (en) Référence BioLib : Viviparus contectus (Millet, 1813)
- (fr) Référence INPN : Viviparus contectus (Millet, 1813) (TAXREF)
Ouvrages ou articles spécialisés
- Boer HH & Sminia T(1976). Sieve structure of slit diaphragms of podocytes and pore cells of gastropod molluscs. Cell and tissue research, 170(2), 221-229 (extrait / résumé).
- Bottke WZ (1973) Zur Ultrastruktur des Ovars von Viviparus contectus (Millet, 1813)(Gastropoda, Prosobranchia). Zeitschrift für Zellforschung und Mikroskopische Anatomie, 138(2), 239-259 ([* Gargominy O, Prié V, Bichain J-M, Cucherat X. & Fontaine B (2011) Liste de référence annotée des mollusques continentaux de France. MalaCo, 7: 307-382 (PDF, 76 pages). résumé]) (de).
- Bottke WZ (1972) Morphological studies on the ovary of Viviparus contectus (Millet 1813), (Gastropoda, Prosobranchia). I. The follicle cells.Zellforsch Mikrosk Anat. ; 133(1):103-18.
- Bugler MJ, Grimes ST, Leng MJ, Rundle SD, Price GD, Hooker JJ, Collinson ME (2009) Experimental determination of a Viviparus contectus thermometry equation ; Rapid Commun Mass Spectrom. 2009 Sep;23(18):2939-51. doi:10.1002/rcm.4203
- Dembski WJ (1968) Histochemical studies of function and fate of the eu-and oligopyrene sperm of Viviparus contectus (Millet 1813), (Gastropoda, Prosobranchia). Zeitschrift für Zellforschung und mikroskopische Anatomie (Vienna, Austria: 1948), 89(2), 151.
- Eleutheriadis, N., & LAZARIDOUDIMITRIADOU, M. (1995). THE LIFE-CYCLE, POPULATION-DYNAMICS, GROWTH AND SECONDARY PRODUCTION OF THE SNAIL VIVIPARUS-CONTECTUS (MILLET)(GASTROPODA, PROSOBRANCHIA) IN THE MARSHES OF THE RIVER STRYMONAS, SERRES, MACEDONIA, NORTHERN GREECE. Malacologia, 37(1), 41-52.
- Gargominy O, Prié V, Bichain J-M, Cucherat X. & Fontaine B (2011) Liste de référence annotée des mollusques continentaux de France. MalaCo, 7: 307-382 (PDF, 76 pages).
- Nasincová V (1991) Viviparus contectus as a new intermediate host of Linstowiella viviparae (Linstow, 1877) (Trematoda: Cyathocotylidae) ; Folia Parasitol (Praha) ;38(1):93-4. (pas de résumé disponible) ;
- Taylor PM & Andrews EB (1991) Non-protein nitrogen excretion in the prosobranch gastropod Viviparus contectus. Journal of molluscan studies, 57(3), 391-393.
Ouvrages généralistes
- Engelhardt W (1998) La vie dans les étangs, les ruisseaux et les mares, ed. Vigot, 316p.
- Félix J, Toman J & Hisek K (1983) Guide du promeneur dans la nature, ed. France-Loisirs, 422p.
- Falkner G, Ripken TEJ & Falkner M (2002) Mollusques continentaux de la France : liste de référence annotée et bibliographie. Patrimoines naturels, 52: 1-350.
- Germain (1931) Faune de France no 22, Mollusques terrestres et fluviatiles (seconde partie) Ed. P. Lechevalier, 897p.
- Germain L., Seguy E(1957) Faune des lacs, des étangs et des... Ed. Paul Lechevalier
- Mulhauser B & Monnier G (1995) Guide de la flore et de la faune des lacs et des étangs d'Europe. Delachaux et Niestlé, Lausanne.
- Olsen LH, Sunesen E, Persersen BV (2000) Les petits animaux des lacs et rivières, « Les compagnons du naturaliste », ed. Delachaux & Niestlé, 236p.
- Tachet H (2006), Invertébrés d’eau douce, systématique, biologie, écologie, Ed. du CNRS, 587 p.
