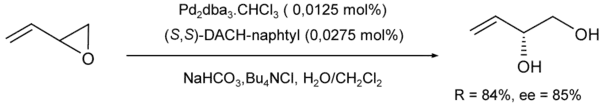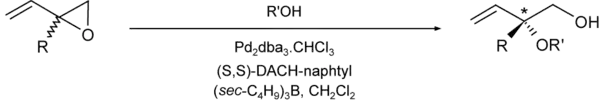Ligand de Trost
Un ligand de Trost est un ligand tétradente organique et chiral de symétrie C2[4].
| Ligand de Trost | ||

| ||
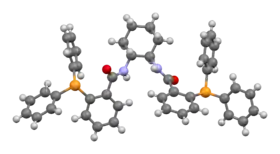 | ||
| (1R,2R)-(+)-1,2-diaminocyclohexane-N,N'- bis(2-diphénylphosphinobenzoyl) - le ligand de Trost | ||
| Identification | ||
|---|---|---|
| Nom UICPA | N,N'-cyclohexane-1,2-diylbis(2-(diphénylphosphanyl)benzamide) | |
| Synonymes |
|
|
| No CAS | (R,R)-(+) (S,S)-(–) |
|
| PubChem | 10963521 (R,R) | |
| SMILES | ||
| InChI | ||
| Apparence | poudre blanche | |
| Propriétés chimiques | ||
| Formule | C44H40N2O2P2 [Isomères] |
|
| Masse molaire[1] | 690,748 1 ± 0,039 g/mol C 76,51 %, H 5,84 %, N 4,06 %, O 4,63 %, P 8,97 %, |
|
| Propriétés physiques | ||
| T° fusion | 136-142 °C[2] - [3] | |
| Propriétés optiques | ||
| Pouvoir rotatoire | = +131° ((R,R), c = 1 in méthanol)[2] = -134° ((S,S), c = 1 in méthanol)[3] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
L'équipe de Barry Trost les a mis au point pour leur utilisation très performante dans des réactions d'alkylation allylique asymétrique (en) catalysées par le palladium et dites, elles aussi, de Trost[5].
Le ligand de Trost est le composé 1,2-diaminocyclohexane (DACH)-(diphénylphosphanyl)phényl qui est le premier ligand de Trost à avoir été synthétisé[6]. Il est aussi appelé le ligand de Trost DACH-phényl.
Synthèse
Les ligands de Trost peuvent être synthétisés de même façon que le ligand de Trost, le composé DACH-phényl :
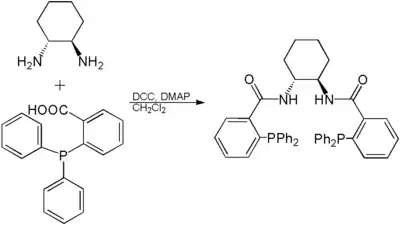 Synthèse du ligand de Trost
Synthèse du ligand de Trost
Le ligand de Trost est synthétisé via l'amidation des énantiomères (R,R) ou (S,S) du 1,2-diaminocyclohexane (DACH) avec l'acide 2-diphénylphosphinobenzoïque. La réaction, analogue à une estérification de Steglich, a lieu dans le dichlorométhane (CH2Cl2) en présence de dicyclohexylcarbodiimide (DCC) et de 4-diméthylaminopyridine (DMAP).
Ainsi sont formés :
| Ligand de Trost | Structure | formule brute | numéro CAS |
|---|---|---|---|
| DACH-naphtyl |  | C52H44N2O2P2 | * (R,R) * (S,S) |
| DACH-pyridyl | 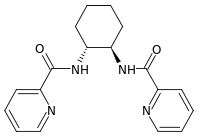 | C18H20N4O2 | * (R,R) * (S,S) |
| ANDEN-phényl |  | C54H42N2O2P2 | * (R,R) * (S,S) |
| etc. |
Utilisation
Les ligands de Trost sont utilisés dans des réactions d’alkylation allylique asymétrique (AAA) catalysées par le palladium. Ces AAA en présence de ligand de Trost et catalysés par le palladium sont exceptionnellement puissantes et efficientes pour la construction de centres stéréogènes optiquement purs par rapport à la plupart des autres méthodes de catalyse[5]. De fait, ces AAA ont la capacité de former plusieurs types de liaisons (C-C, C-O, C-N, C-S)[5].
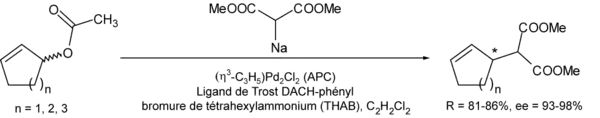
- Le ligand de Trost fut mis au point en même temps que l'alkylation allylique asymétrique de Trost faite avec comme nucléophile le malonate de diméthyle déprotoné[7] - [8] - [9] :
Une liaison C-C peut aussi être créée en utilisant comme nucléophile des dérivés d'acide barbiturique, des β-céto ester, des nitrosulfonyles, des nitroalcanes, etc.[10]
- Les ligands de Trost peuvent aussi catalyser la formation de liaison C-N dans des AAA/Pd avec des nucléophiles amine par exemple[11]:
En plus des alkylamines, des azotures tel l'azoture de triméthylsilyle, des sulfonamides, des imides, etc. peuvent être utilisés comme nucléophile pour créer des liaisons C-N[10].
- Des liaisons C-O peuvent être créées de la même façon :
Des carboxylates, des carbonates/hydrogénocarbonates peuvent aussi servir de nucléophiles[10].
- Les ligands de Trost peuvent également catalyser la formation de liaison C-S de sulfones chirales[18] :
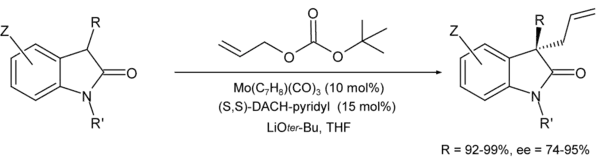
De plus, certaines AAA catalysées par le molybdène peuvent être plus régio-, énantio- ou diastéréosélectives que celles catalysées par le palladium[10]. Le ligand de Trost DACH-pyridyl est prépondérant pour ce genre de réaction[19] :
Notes et références
- articles Trost ligands et Asymmetric Allylic Alkylation chez Sigma-Aldrich
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Trost ligand » (voir la liste des auteurs).
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Trost-Ligand » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé (R,R)-DACH-phenyl Trost ligand 95%.
- Fiche Sigma-Aldrich du composé (S,S)-DACH-phenyl Trost ligand 95%.
- précision pour exclure les composés méso qui ne sont donc pas des ligands de Trost
- Article Trost ligands chez Sigma-Aldrich.
- B.M. Trost, O. R. Thiel, H. C. Tsui, DYKAT of Baylis–Hillman adducts: Concise total synthesis of furaquinocin E., J. Am. Chem. Soc., 2002, vol. 124, p.11616-11617.
- B. M. Trost, R. C. Bunt, Asymmetric induction in allylic alkylations of 3-(acyloxy)cycloalkenes, J. Am. Chem. Soc., 1994, vol. 116(9), p. 4089-4090. DOI 10.1021/ja00088a059.
- M. Ernst, G. Helmchen, A novel route to iridoids: Enantioselective syntheses of isoiridomyrmecin and α-skytanthine., Synthesis, 2002, vol.10, p. 1953-1955. DOI 10.1055/s-2002-34382.
- M. Ernst, G. Helmchen, A new synthesis route to enantiomerically pure jasmonoids, Angew. Chem. Int. Ed., 2002, vol. 41(21), p. 4054-4056. DOI 10.1002/1521-3773(20021104)41:21<4054::AID-ANIE4054>3.0.CO;2-K.
- Article Asymmetric Allylic Alkylation chez Sigma-Aldrich.
- B. M. Trost, M. J. Krische, R. Radinov, G. Zanoni, J. Am. Chem. Soc., 1996, vol. 118, p. 6297-6298.
- I. C. Lennon et al., Chimica Oggi (Chemistry Today), 2004, 11.
- Barry M. Trost, Brian S. Brown, Ernest J. McEachern, Oliver Kuhn, Asymmetric synthesis of oxygen heterocycles via Pd-catalyzed dynamic kinetic asymmetric transformations: Application to nucleosides, Chem.-Eur. J., 2003, vol. 9(18), pp. 4442–4451. DOI 10.1002/chem.200304949.
- B. M. Trost, W. Tang, J. Schulte, Org. Lett., 2000, vol. 2, pp. 4013-4015.
- B. M. Trost, N. G. Anderson, J. Am. Chem. Soc., 2002, vol. 124, pp. 14320-14321.
- B. M. Trost, W. Tang, W., Org. Lett., 2001, vol. 3, p. 3409.
- B. M. Trost, T. Zhang, Org. Lett., 2006, vol. 8, pp. 6007-6010.
- B. M. Trost, M. L. Crawley, C. B. Lee, J. Am. Chem. Soc., 2000, vol. 122, p. 6120.
- Barry M. Trost, Yong Zhang, Mo-catalyzed regio-, riastereo-, and rnantioselective allylic alkylation of 3-aryloxindoles, J. Am. Chem. Soc., 2007, vol. 129(47), pp. 14548–14549. DOI 10.1021/ja0755717.